权威专家点评 | YESCARTA®首获FDA批准用于二线LBCL治疗,CAR-T疗法里程碑式新进展
2022-04-15 18:10:00来源:医脉通阅读:12次
全球每年约有150,000例大B细胞
ZUMA-7研究结果助力审批,Axi-cel疗效显著优于标准治疗
此次Axi-cel在FDA获批新适应证是基于ZUMA-7研究2的结果。ZUMA-7研究是一项随机、开放标签的全球性、多中心Ⅲ期临床研究,评估了一线治疗后12个月内复发或难治性LBCL成年患者接受Axi-cel或既往二线标准治疗的安全性和有效性。研究共入组359例患者,中位随访24.9个月,Axi-cel显示出具有统计学意义的显著的临床优势。与标准治疗相比,Axi-cel将LBCL患者的无事件生存期(EFS)延长了6.3个月(8.3个月 vs 2.0个月)(图1),2年EFS率提高了约1.5倍(40.5% vs 16.3%),且安全性良好。
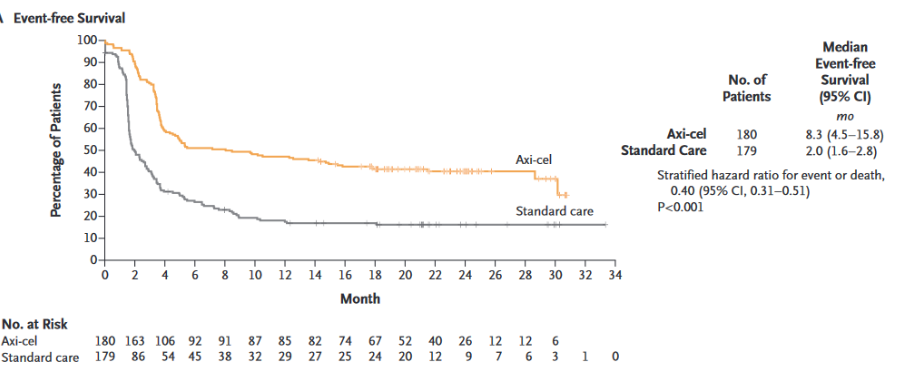
图1 ZUMA-7研究Axi-cel VS 标准治疗的EFS
此外,在2021年ASH会议上公布的ZUMA-7研究3患者报告结果显示,与标准治疗相比,Axi-cel在多个维度上显著改善了一线治疗后12个月内复发或难治性LBCL患者的生活质量。
首获NCCN指南1类推荐,Axi-cel多次实现里程碑式突破
由于Axi-cel具有突出疗效,多次实现了CAR-T疗法在LBCL治疗领域的里程碑式突破。2017年10月,Axi-cel成为全球首个获批治疗复发或难治性LBCL成人患者的CAR-T药物。2022年3月,美国国立综合癌症网络(NCCN)将Axi-cel纳入弥漫性LBCL针对"12个月内复发疾病或原发性难治性疾病"治疗的1类推荐,Axi-cel成为所有类型癌症治疗中首个被NCCN指南作为1类推荐的CAR-T药物4。2022年4月,Axi-cel成为全球首款且唯一获得FDA批准作为LBCL二线疗法的CAR-T药物。
在中国,复星凯特作为复星医药集团与美国Kite合资企业,取得Yescarta®技术授权以及商业化权利。2021年6月份,国家药品监督管理局已正式批准该产品奕凯达®(阿基仑赛注射液)的新药上市申请,成为中国首个获批上市的细胞治疗类产品,用于治疗既往接受二线或以上系统性治疗后复发或难治性LBCL成人患者。
YESCARTA®—— CAR-T进入二线治疗,国内权威专家点评
(按姓氏中文拼音字母排序,排名不分先后)
胡豫 教授 华中科技大学同济医学院附属协和医院:Yescarta®获批用于二线LBCL治疗后,既往未能从标准治疗中获益的患者,尤其是不适合移植的患者迎来了治愈的曙光。Yescarta®为早期复发和难治性LBCL患者提供了新的选择,为LBCL的治疗打开了新的篇章!
黄晓军 教授 北京大学人民医院:Yescarta®在FDA成功获批二线疗法,标示LBCL的治疗格局有望重塑。Yescarta®是当下肿瘤治疗领域最具前景的免疫疗法之一,CAR-T在更多血液肿瘤中应用,预示未来能使更多的血液肿瘤患者延长生存时间、提高生活质量!
赵维莅 教授 上海交通大学医学院附属瑞金医院:LBCL进入精准医疗时代的治疗,“All roads lead to targeted diffuse large B-cell lymphoma approaches”。CAR-T疗法作为细胞免疫治疗的重大突破,是一种非常有前景的疗法。Axi-cel在全球使用已经超过5年,在中国上市后也积累了很多成功经验,随着精准时代的到来,会有更多患者获益,遇见治愈希望!
朱军 教授 北京大学肿瘤医院:Yescarta®新适应证在FDA的获批是医生和患者期盼已久的好消息,为一线治疗后复发/难治的LBCL患者带来了疗效更好、安全性更佳的细胞免疫治疗选择,随着中国CAR-T获批和商业化使用,医疗团队获得更多使用经验、完善全程管理,帮助更多患者遇见治愈希望!






参考文献
1. Sehn,et al.The New England journal of medicine vol. 384,9 (2021): 842-858.
2. Locke,et al.The New England journal of medicine,10.1056/NEJMoa2116133. 11 Dec. 2021.
3. Locke,et al. ASH 2021. Abstract #2.
4. NCCN Guidelines Version 2.2022 Diffuse Large B-Cell