ASCO大咖评谈 | 盛锡楠教授团队:晚期尿路上皮癌治疗进展
2022-06-05 18:01:56来源:医脉通阅读:10次
近年来,转移性尿路上皮癌(mUC)的药物治疗取得快速发展,PD-(L)1单抗、ADC药物、FGFR抑制剂等带来了新的突破,使得治疗格局发生了很大的变化。新型治疗药物及各种联合治疗不断向前线推进,有望进一步提高疗效。今年ASCO大会公布及更新了多项临床研究的结果,虽然没有大型临床研究,但对既往研究的深入分析可以给我们进行临床决策时提供新的线索和启发。本文就2022年ASCO大会中关于晚期尿路上皮癌相关的治疗进展进行梳理,以飨读者。

一、 抗HER2-ADC治疗获得成功
尿路上皮癌HER2表达水平仅次于
1.抗HER2-ADC在HER2阳性患者的应用
维迪西妥单抗毫无疑问是晚期尿路上皮癌抗HER2-ADC领域的先行者,既往RC48-C005研究报道,RC48-ADC在铂类药物治疗失败的HER2阳性局部晚期或转移性UC患者中显示出良好的疗效。本次大会报道了RC48-C005和RC48-C009两项单臂、多中心、II期研究的汇总分析,进一步更新了疗效、安全性和生存随访数据,这也是目前全球最大宗抗HER2-ADC治疗数据。研究纳入既往常规化疗失败的转移性尿路上皮癌患者,经中心实验室证实组织学HER2阳性 (IHC2+/3+),主要终点是客观反应率(ORR),次要研究终点包括PFS、OS和安全性。从2017年11月至2020年9月,两项研究计107例HER2阳性的局部晚期或转移性UC患者。其中80名男性,中位数年龄63岁(40-79),64.5%的患者接受了≥2线的全身化疗, 90.7%的患者有内脏转移。截至2021年9月4日,BIRC评估的总体确认的ORR为50.5%。分层分析显示不同亚组疗效相近,肝转移患者的cORR为52.1%,之前接受过PD-1/L1治疗患者的cORR为55.6%。HER2 IHC3+或IHC2+FISH+患者cORR为62.2%,HER2 IHC2+FISH-者为39.6%。DCR为82.2%(95% CI:73.7%,89.0%)。mPFS为5.9 个月,mOS为14.2个月。最常见的TRAE是感觉减退 (50.5%)、白细胞减少(49.5%)、转氨酶升高(43.0%)、中性粒细胞减少(42.1%)、脱发(40.2%)、乏力(39.3%)、
此外国内研发的另外一款抗新型HER2靶向ADC药物MRG002也报道了在晚期尿路上皮癌中的初步疗效。MRG002-006是一项单臂、多中心的 II 期研究,入组既往标准治疗失败的HER2阳性(IHC 2+ 或 3+)晚期尿路上皮癌患者。在剂量扩展阶段给予MRG002 2.2mg/kg或2.6 mg/kg Q3W,随后基于初步结果进行剂量扩展阶段。主要终点是ORR,次要终点是安全性、DOR、PFS和OS。截至2022年4月1日,研究共入组43例患者。9例患者以2.6 mg/kg给药,34例患者给予2.2 mg/kg剂量。67%患者接受至少2线治疗,81%患者之前接受过免疫检查点抑制剂 (ICI) 治疗。38例可评估疗效患者中,ORR为55%,其中CR率8%,DCR为89% (95% CI: 75.9-95.8),中位PFS为5.8个月。亚组分析显示,在既往含铂化疗及免疫治疗失败的患者中ORR为63%,中位PFS为6.4个月。最常见的TRAE为

2. 抗HER2-ADC与免疫治疗联合的应用
RC48-C014是一项探索RC48-ADC联合

3. 抗HER2-ADC在HER2阴性患者中的应用
RC48-C011是一项评估RC48-ADC在常规化疗失败后HER2阴性晚期尿路上皮癌患者中活性和安全性的研究。研究入组HER2阴性(IHC 0或1+)并接受≥1次全身治疗的转移性尿路上皮癌患者。截至2022年2月,共有19名患者入组,其中6例HER2免疫组化表达为0,13例HER2免疫组化表达为1+。中位年龄为64岁(范围:36-77),68%的患者有内脏转移,79%接受了2线及以上的治疗。结果显示,所有患者客观缓解率为26.3%(95% CI:9.1%,51.2%),DCR为94.7%,中位PFS为5.5个月 (95% CI: 3.9,6.8),中位OS为16.4个月(95% CI: 7.1,21.7)。亚组分析显示13例HER2 IHC 1+的患者ORR为38%,而HER2表达为0的患者最佳疗效仅为稳定。另外全体人群中内脏转移、肝转移以及既往二线治疗以上患者的ORR分别为31%、17%和27%。安全性方面与既往报道的数据基本类似。

二、 免疫联合治疗探索不断
PD-1/L1单抗为代表的免疫治疗为晚期尿路上皮癌带来了突变,使得晚期尿路上皮癌的治疗格局发生改变,但单药治疗仅仅在化疗失败的二线治疗以及一线化疗有效后维持治疗中取得成功,而其他情况下,免疫治疗更多的是采取联合治疗策略,与常规化疗、靶向治疗以及ADC治疗是研究的重点。
1.抗血管靶向治疗联合免疫治疗
虽然免疫治疗时代前舒尼替尼、
COSMIC-021是一项多中心1b期研究,评估卡博替尼联合



虽然抗血管靶向药物联合免疫治疗能够让部分患者治疗获益,但均为小样本研究,而且临床数据不具有显著性,结合2022年ASCO-GU大会公布的3期随机对照的LEAP-011研究结果,对于不能耐受铂类的患者,免疫联合
2. AXL抑制剂联合免疫治疗
AXL是哺乳动物Tyro3/AXL/Mer (TAM)受体酪氨酸激酶家族的成员,与其配体Gas6结合可促进肿瘤微环境中的免疫抑制。AVB-S6-500 (AVB) 是一种新型AXL通路抑制剂,可与循环Gas6结合并抑制配体依赖性AXL信号传导。一项Ib期研究评估了AVB联合avelumab在转移性尿路上皮癌患者中的安全性和抗肿瘤活性(NCT04004442)。研究纳入既往铂类治疗失败或不能耐受且未接受过免疫治疗的转移性UC患者,采用3+3剂量递增设计,给予avelumab 800mg Q2W联合四个剂量组的AVB给药,分别为5mg/kg QW(DL1)、10(DL2)、15(DL3)或 20(DL4)mg/kg Q2W。主要研究终点为安全性和耐受性,次要研究终点为ORR,PFS、DOR和OS等。研究共入组16例患者(DL1:n = 3,DL2:n = 7,DL3:n = 3 ,DL4:n = 3)。1例患者发生DLT(3级疲劳;DL2)。常见不良反应包括乏力、输注反应、腹泻、低钾血症、肌肉痛等。6例患者发生3级以上不良反应,其中包括

3.化疗联合
既往有研究探索紫杉类化疗药物联合免疫治疗的疗效,如ABLE研究(白蛋白紫杉醇联合

三、维持治疗越来越受到重视
晚期尿路上皮癌一线化疗有效率高,但其后容易出现复发转移,延缓复发是临床中需要解决的问题。JAVELIN Bladder 100研究证明了在一线铂类化疗缓解或稳定的患者得到疾病控制后,给予avelumab进行维持治疗的生存获益,使得晚期尿路上皮癌的维持治疗格局取得突破,改变了临床实践。本次大会数项研究关注一线治疗后的维持治疗,值得指导临床。
1.免疫支持治疗
JAVELIN Bladder100研究有两项研究更新了Javelin Bladder 100后续长期随访的结果。一项研究报道了按照对一线化疗疗效进行的亚组探索性分析。截至2021年6月4日,两组的中位随访时间≥38个月。在不同亚组中,avelumab+BSC与单独BSC组的中位OS和接受二线治疗的比例分别为:CR亚组39.8vs 26.8个月(二线治疗比例50.0% vs 74.2%);PR亚组19.2vs 12.8个月(二线治疗比例58.3% vs 71.8%);SD亚组22.3 vs 14.0个月(二线治疗比例46.4% vs 70.4%)。研究结果表明,无论对一线化疗的反应如何,应用avelumab维持治疗可延长患者的PFS和OS。
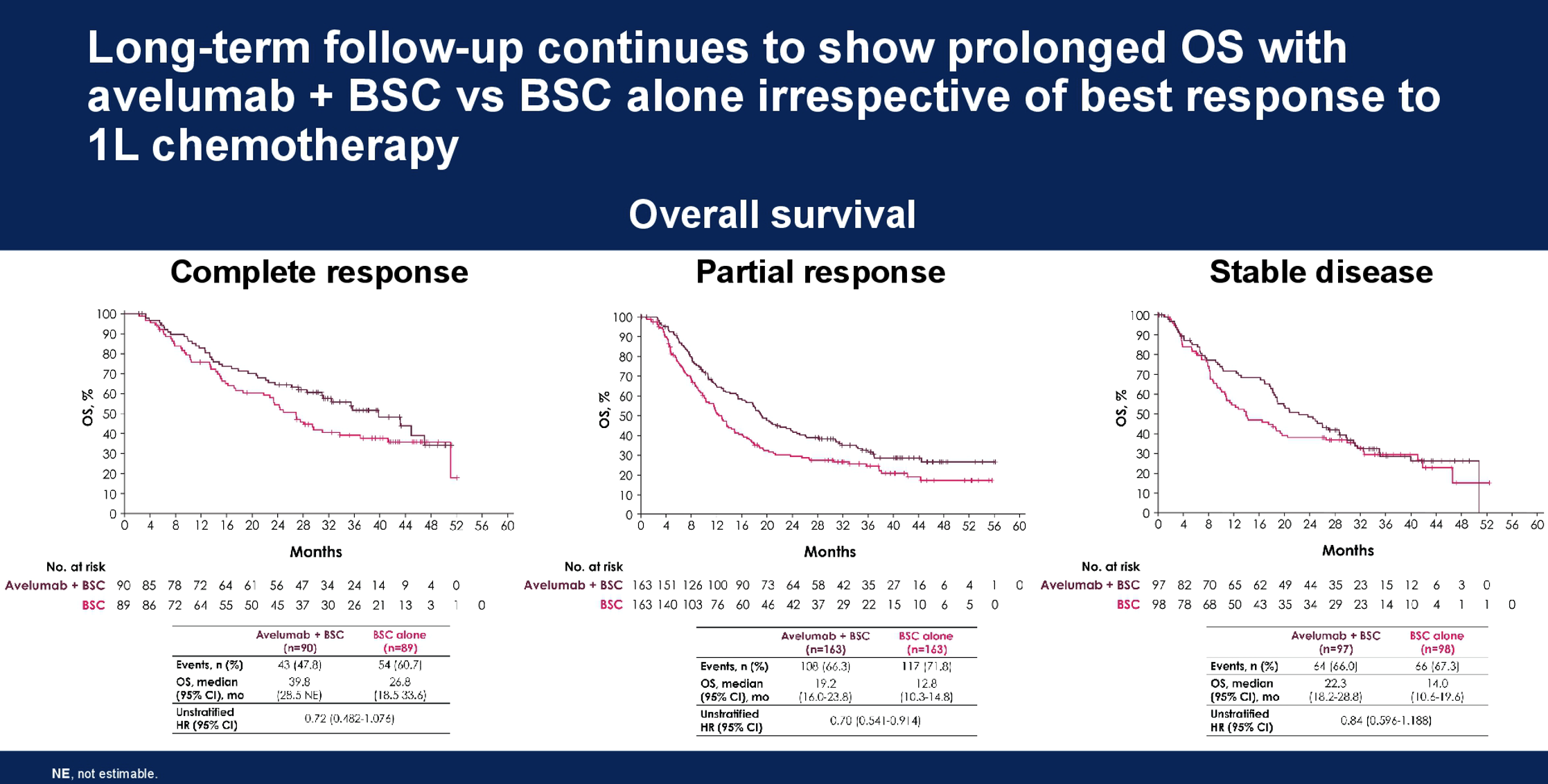
另一项研究报道了avelumab维持后不同治疗选择患者的生存结局。截至2021年6月4日,avelumab治疗组中位随访时间38个月,有43例患者仍在继续治疗,185例患者停止治疗后接受了二线治疗,包括75例应用含铂化疗进行再治疗,11例PD-(L)1治疗,以及99例其他治疗(长春氟宁n=35,紫杉醇n=28,EV n=9,多西他赛n=5,pemigatinib 5例和erdatinib 2例等),另外122例患者停止avelumab治疗后未接受其他治疗。结果显示,三组中位生存时间分别为未达到、19.9和18.2个月。因此,avelumab维持治疗的患者无论后续是否接受二线治疗均获得较长的生存期。以上研究结果进一步支持avelumab维持作为铂类化疗未进展的晚期尿路上皮癌患者的标准治疗。

2. 单药抗血管靶向治疗尚不能用于维持治疗
卡博替尼是一种多靶点包括MET、VEGFR、 AXL和RET等的受体酪氨酸激酶抑制剂,既往研究曾显示其在铂类治疗失败尿路上皮癌中的临床活性。本次ASCO大会公布了ATLANTIS研究中生物标记物(包括DRD和AR)阴性组应用卡博替尼对照安慰剂维持治疗的结果。研究纳入不可切除或转移性尿路上皮癌,既往4-10周期化疗未进展的患者,给予卡博替尼40mg Qd或安慰剂治疗,主要研究终点为PFS,次要研究终点包括OS、cORR以及安全性和耐受性。最终入组61例生物标记物阴性患者,其中既往顺铂治疗失败者70%。结果显示,卡博替尼和安慰剂组PFS分别为13.7周和15.8周(P=0.35),两组OS分别为75.5周(80%CI: 43.4-117.6)和82.9周(80%CI: 58.0-117.1)(P=0.25),均未达到显著统计学差异,ORR分别为3.3%和6.5%。安全性方面卡博替尼总体耐受性尚可,两组之间有显著差异的不良反应为厌食(30%)、腹泻(40%)、乏力(56.7%)、高血压(43.3%)、

以上为大家梳理2022年ASCO大会晚期尿路上皮癌治疗的最新进展,涉及靶向治疗、抗体偶联药物、免疫治疗以及多种联合治疗方式。晚期尿路上皮癌的治疗不断取得突破,特别是国内在尿路上皮癌的抗HER2治疗方面走在了世界前列。抗体偶联药物联合免疫治疗的临床研究正在进行中,初步已显示出优异的抗肿瘤活性,未来可能改变晚期尿路上皮癌的治疗格局。
参考文献:Program Guide – ASCO Meeting Program Guide