一文总结:肺癌领域里程碑式共价药物进阶史
2023-01-03 09:27:04来源:医脉通阅读:13次
编辑:Yuna
医脉通整理,未经收取请勿转载。
阿司匹林是一种历史悠久的解热镇痛药;
共价药物的历史
历史上共价药物通常在广泛使用后才被发现是通过共价机制发挥作用。其中最突出的代表是非甾体抗炎药阿司匹林,1971年科学家发现,阿司匹林是通过乙酰化环氧合酶1底物结构中的Ser529来发挥抗炎作用,阻止花生四烯酸转化为前列腺素。
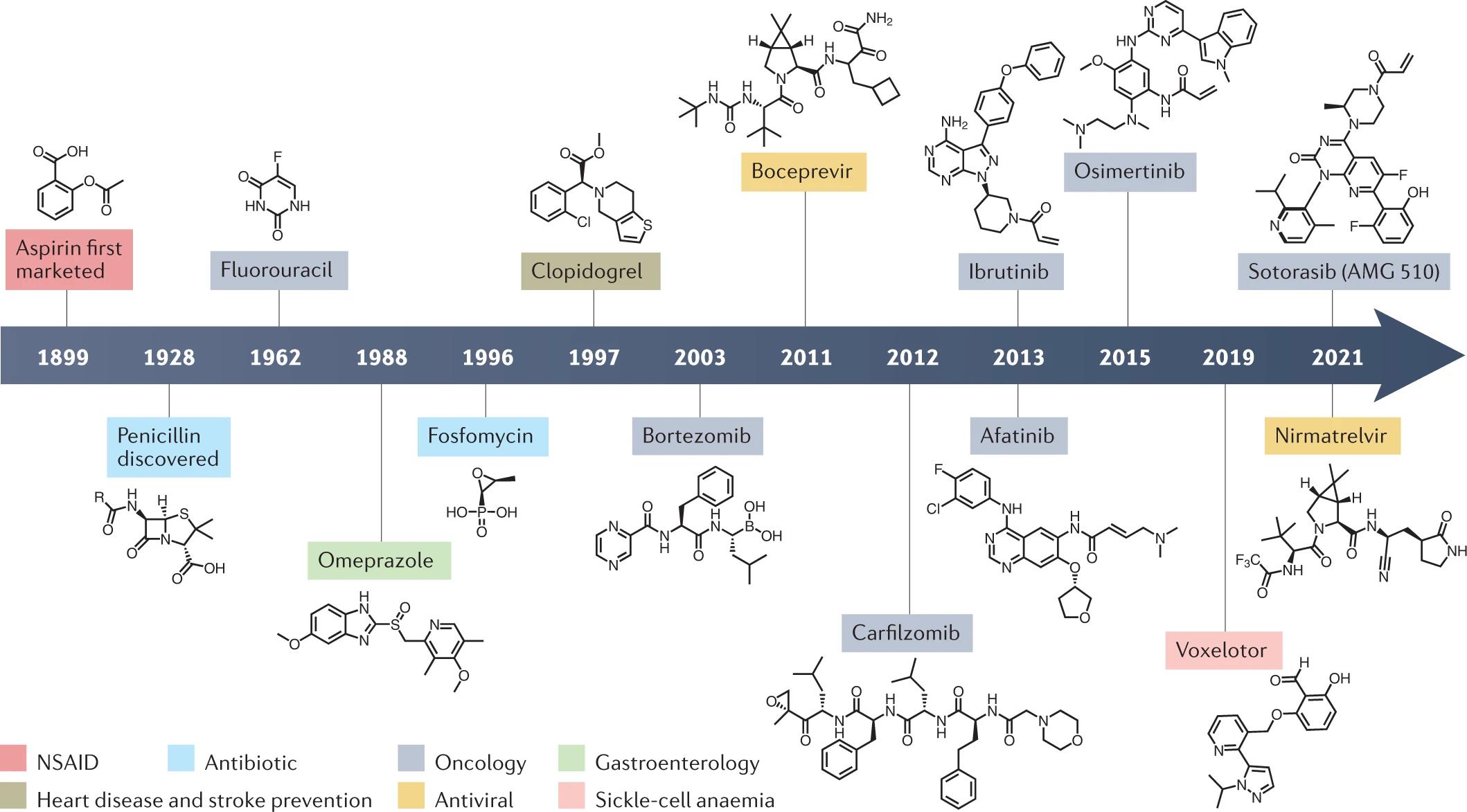
图1 主要共价药物研发时间
共价药物在癌症治疗中具有重要的历史意义。嘧啶核苷类似物 5-
共价药物已被用于治疗多种疾病。药物研发之前专注于共价作用机制,以改进药物设计,可为难以解决的“新挑战”提供新思路。
经配体优先方法(ligand-first approaches)研发的药物
在过去十年中,共价药物发现已具有里程碑意义,FDA于2013年批准了第一个共价EGFR抑制剂
共价EGFR抑制剂
EGFR抑制剂的发现推动了

图2 EGFR抑制剂结构的不断演变
为了克服这一难题,研究者设计将共价第二代抑制剂中加入丙烯酰胺迈克尔受体,其与EGFR中的半胱氨酸残基(Cys797)反应(图2b)。Cys797位于ATP结合位点附近,EGFR与EGFR配体的不可逆结合部分恢复了对T790M 看门人突变体的活性。除了对T790M有一定活性之外,共价第二代抑制剂可长期抑制EGFR信号传导通路,这提示第二代EGFR 抑制剂可能比可逆的第一代抑制剂更有效。
阿法替尼于2013年获FDA批准用于EGFR敏感突变转移性 NSCLC 患者的一线治疗。其他第二代抑制剂包括来那替尼和
第三代EGFR抑制剂选择性靶向 T790M 突变体而非野生型 EGFR,包括 WZ4002、
共价BTK抑制剂
共价BTK抑制剂的发现与共价EGFR抑制剂有几个共同点:配体优先方法和具有亲电性的迈克尔反应受体的使用。由于BTK在 B 细胞受体下游通路的关键作用而成为
与EGFR抑制剂类似,伊布替尼与BTK中ATP结合位点相邻的半胱氨酸残基 (Cys481)结合,只有少数激酶具有同源半胱氨酸,因此伊布替尼对BTK 的选择性高于其他激酶。由于长期共价结合,伊布替尼可保持对 BTK的活性。
其他几种共价BTK抑制剂已获批准或目前正在进行临床试验,其中一些药物突出了迈克尔受体的多样性,有多种亲电体可代替丙烯酰胺。Acalabrutinib于2019年获得FDA批准用于治疗CLL,它使用丁酰胺亲电体取代了丙烯酰胺。研究人员进一步使用氰基丙烯酰胺亲电体来设计可逆共价 BTK 抑制剂。与不可逆共价BTK抑制剂相比,它可显示更高的疗效和更低的脱靶效应。
除靶向EGFR 和 BTK之外,其他共价抑制剂正在研发中。总体上,靶向与ATP 结合位点相邻的非保守半胱氨酸的共价激酶抑制剂的合理设计已成为提高激酶抑制剂疗效和选择性的常规方法。
经亲电优先方法(electrophile-first approaches)研发的药物
共价药物也可通过亲电体优先方法研发而来,这提示最初的发现过程是一开始就找到共价配体,而不是将共价受体结合到已知可逆配体中。通过这种方法发现的药物主要包括 KRAS G12C抑制剂 sotorasib 和 SARS-CoV-2 M前抑制剂 nirmatrelvir等(图1)。
共价KRAS G12C 抑制剂
共价KRAS G12C抑制剂是共价药物中最令人兴奋的研发事件之一。KRAS是一种编码 GTPase的癌基因,所有癌症中约25%可能发生该突变,尤其是在
自从近30年前,研究者发现KRAS可能是肿瘤发生的潜在靶点,但一直以来传统药物研发方法均未获得成功。KRAS没有可用于可逆抑制剂结合的“口袋”,竞争性抑制剂需要克服 GTP和GDP之间皮摩尔级别的亲和力,而对野生型 KRAS有活性的抑制剂可能会增加靶向毒性。
靶向G12C突变的共价KRAS抑制剂之所以有吸引力,有几个原因:首先,靶向KRAS突变可以对癌细胞产生选择性细胞毒性。第二,通过共价结合的亲和力更有优势,因为KRAS缺乏结合配体的口袋。第三,NSCLC中有12%-14% KRAS突变为KRAS G12C突变,这类患者将直接获益于KRAS G12C抑制剂。第四,共价KRAS G12C配体可能影响 KRAS 功能。
2013年,加利福尼亚大学旧金山分校研究人员报告了首个选择性共价KRAS G12C抑制剂。这种新型选择性KRAS G12C抑制剂的新机制为临床上开发共价KRAS G12C抑制剂奠定了基础。后续陆续研发抑制剂包括ARS-853、ARS-1620。ARS-1620研发中努力克服 ARS-853的代谢稳定性和生物利用度限制,最终被认定为首个适用于体内研究的KRAS G12C抑制剂。
Sotorasib是首个于 2018年进入临床试验的选择性 KRAS G12C抑制剂。科学家发现了KRAS结构中既往未知的“神秘口袋”,并利用此结构研发出sotorasib。Sotorasib通过与His95、Tyr96和Gln99相互作用并占据或结合该“神秘口袋”(图3)。基于2020年取得成功的II期临床研究,Sotorasib于2021 年5月获得FDA批准用于KRAS G12C突变局部晚期或转移性 NSCLC的成人患者。其他共价KRAS G12C抑制剂正逐步进入临床或临床试验。Adgrasib是一种不可逆共价抑制剂,研究者随后使用基于结构的设计方法优化了adgrasib,该药物于2019年1月开始临床试验(图3)。此外,研究者也探索了JNJ-74699157(ARS-3248)在KRAS G12C晚期实体瘤中的疗效,但临床试验已终止。

图 3 adagrasib(MRTX849)和 sotorasib(AMG-510)的结构
设计小分子共价 KRAS G12C选择性抑制剂给出了一种药物研发的解决方案,可以为不可成药肿瘤靶点提供药物。在KRAS G12C抑制剂之前,最近在肿瘤学领域研发的靶向共价抑制剂大多是使用配体优先方法鉴定。
展望
在过去的十年中,共价药物发现的进步成就了多种成功药物,包括 EGFR、BTK、KRAS G12C抑制剂等。这些药物都代表了里程碑式进展,显示了共价药物的研发已从偶然性发现到已确立成功设计路径的演变。
采用亲电优先方法的策略又代表着该领域的进展和转变。预计亲电优先方法将被越来越多地采用,特别是当发现可逆配体具有挑战性时。可逆共价机制的进一步探索将在疗效和选择性之间更好地平衡。
“共价药物发现史”克服了针对“不可成药”蛋白靶点的配体设计障碍。预计共价配体的独特性将继续推动共价药物的发现。
参考文献:Boike L, Henning NJ, Nomura DK. Advances in covalent drug discovery. Nat Rev Drug Discov. doi: 10.1038/s41573-022-00542-z. Epub ahead of print. PMID: 36008483; PMCID: PMC9403961.