一文总结 | 肝内胆管癌的药物治疗策略
2023-02-08 20:05:42来源:医脉通阅读:10次

图1 ICC的治疗策略¹
ICC的疾病分期及流行病学
按照原发性解剖学分类,胆管癌可分为ICC、肺门周围胆管癌(pCC)或远端胆管癌(dCC)。如图2所示,ICC位于肝实质内的二级胆管近端,pCC位于二级胆管和胆囊管以及肝总管交界处,dCC则局限于胆总管,最常见于胰腺内胆管¹⁻³。
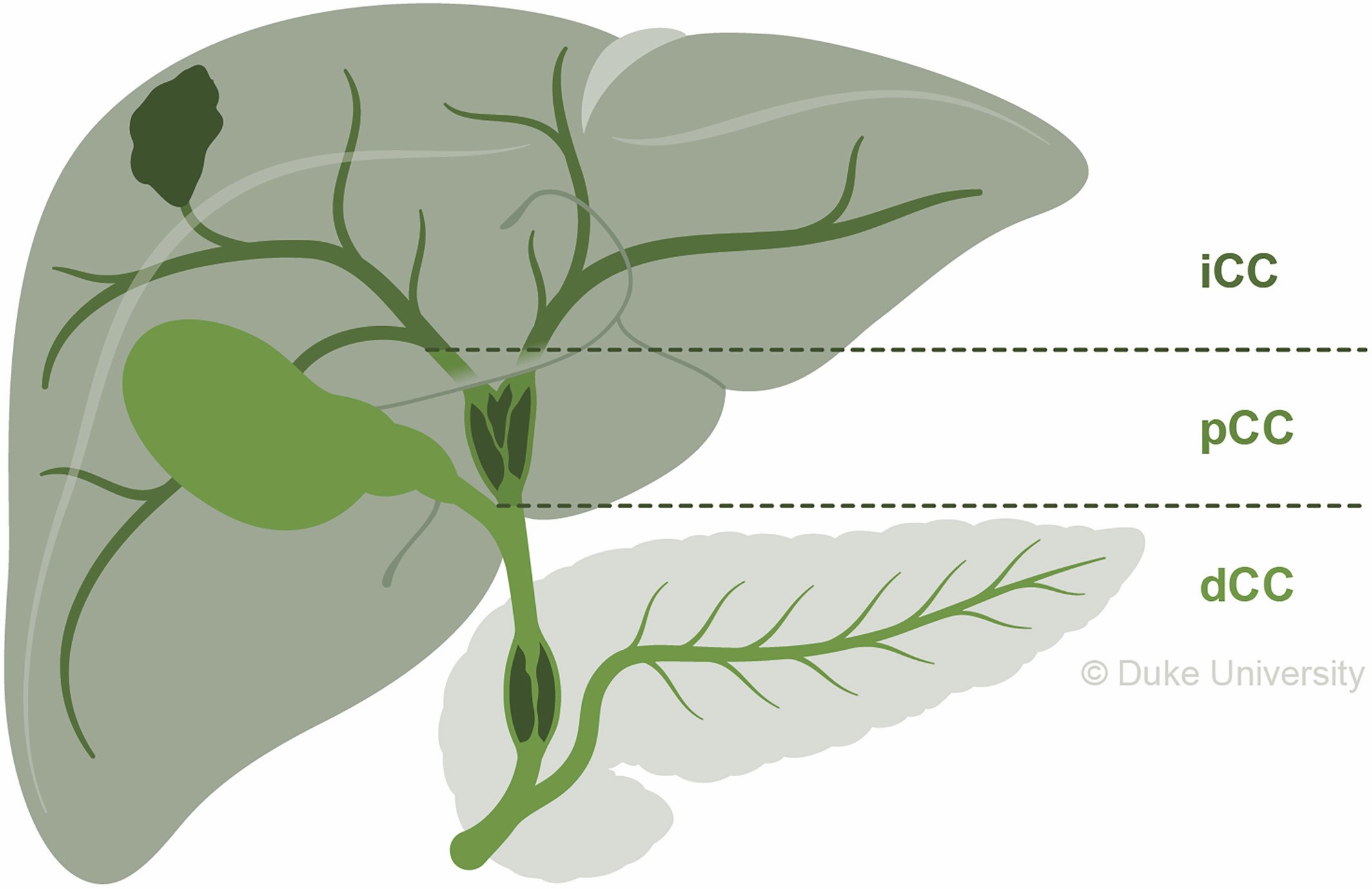
图2. ICC、pCC和dCC的解剖位置¹
ICC最常用的分期标准是肿瘤、淋巴结和转移(TNM)分期,最初由美国癌症联合委员会(AJCC)于2010年在第七版AJCC癌症分期手册中确定。在随后的第八版分期手册中,AJCC对肿瘤大小(≤5或>5cm)、T分期以及淋巴结阳性所属分期等预后因素进行了修订。
ICC在西方国家的发病率较低,而在东南亚国家较高。但令人担忧的是,在过去40年中,ICC的发病率在大多数国家均有所增加,例如在美国,ICC的发病率从1973年的0.44/10万人上升至1.18/10万人,上升幅度超过100%⁴。此外,美国ICC的死亡率也在上升,已从1999年的2.2/10万人上升为3.0/10万人。对于男性,ICC粗死亡率从1999年的2.9/10万人上升为2015年的5.0/10万人;对于女性,ICC粗死亡率从1999年的2.7/10万人上升为2015年的4.6/10万人。
ICC的术后辅助化疗
单纯评估可切除ICC辅助治疗的研究较为少见,研究通常会同时纳入
BILCAP试验是一项多中心、随机、III期试验,共纳入447例胆道恶性肿瘤患者。该研究中,患者被随机分配接受
然而ICC患者的辅助治疗临床需求仍未彻底得到满足,因此多项旨在进一步探索辅助治疗方案的临床试验正备受关注,包括评估吉西他滨和顺铂联合用药的ACTICCA-1研究、评估S-1辅助化疗的JCOG1202研究等,另有一项评估GEMOX对比卡培他滨疗效的III期随机试验和一项评估
ICC的新辅助化疗
对于可切除的ICC患者,新辅助治疗存在多种理论上的获益,包括抑制微转移灶以降低疾病的早期复发风险、缩瘤降期以实现R0切除等,然而目前ICC患者的新辅助治疗获益情况尚未得到前瞻性大型III期随机对照研究的证实。
在已有的证据中,一项回顾性研究提示,对于I-III期的ICC患者,与术后辅助化疗相比,术前新辅助化疗可延长患者OS(中位OS为40.3个月 vs. 32.8个月;p=0.01)⁷。另一项纳入4000多例患者的队列研究提示,与直接手术相比,新辅助治疗可将患者的死亡风险降低23%⁸。2022年ASCO年会中,II期单臂NEO-GAP试验评估了吉西他滨+顺铂+白蛋白紫杉醇联合用于ICC患者新辅助治疗的疗效,研究纳入30例IB-IIIB期ICC患者,主要终点为术前治疗和手术的完成率,以及不良事件的发生率。结果显示,77%的患者完成了所有的术前化疗和根治性手术,33%的患者发生≥3级治疗相关不良事件(TRAEs)。患者的部分缓解(PR)率为23%,疾病控制率(DCR)为90%⁹。
另有三项临床研究正在进行中,其中一项单中心II期试验NCT03603834旨在评估mFOLFOXIRI(5-FU+LV+
ICC的经动脉化疗栓塞(TACE)
对于晚期或局部晚期ICC患者,肿瘤因临床技术限制、生物学因素或患者个人选择等原因而无法行根治性切除,TACE等局部治疗是此类患者重要的疾病控制手段。TACE可控制肝脏肿瘤的血供,并使得抗肿瘤药物富集于肝脏肿瘤,从而最大程度发挥抗肿瘤效应并减少治疗的肝毒性和全身毒性。
TACE中化疗药物的选择较为丰富,且不同药物间的疗效存在显著异质性。现有研究表明,TACE与顺铂、
ICC的肝动脉灌注化疗(HAIC)
除TACE外,HAIC也是一种重要的局部治疗策略。HAIC通过手术将皮下泵植入ICC患者体内,并利用动脉循环将高剂量的化疗药物直接输送到肝脏。HAIC可将肝脏中的药物浓度富集至全身给药浓度的400倍¹¹,该策略已成为
近期,部分研究数据提示HAIC应用于晚期不可切除ICC患者或可取得可观的疗效,有三项II期前瞻性试验对HAIC在ICC患者中的应用进行了探索,研究所报告的中位OS范围为25.0-29.5个月¹²⁻¹⁴。其中一项II期单臂研究对HAIC联合GEMOX化疗的应用进行了评估,研究纳入38例不可切除ICC患者。结果显示,患者的DCR为84%,PR率为58%,患者的中位PFS为11.8个月,6个月PFS率为84%,中位OS为25个月¹⁴。基于这些结果,一项大型、多中心、随机对照、II期前瞻性研究正在进行中,该研究纳入164例无法切除的ICC患者,评估了HAIC联合GEMOX对比单纯GEMOX在一线治疗中的疗效和安全性,该研究的主要终点为PFS,期待该研究的结果披露。
ICC的全身化疗
对于不可切除和转移性的ICC患者,全身化疗是疾病控制的关键组成部分。2010年公布的ABC-02试验中,吉西他滨+顺铂方案使患者获得了11.7个月的中位OS和8个月的中位PFS,DCR可达81%,该方案也因此成为了ICC患者一线治疗的首选方案¹⁵。除此方案外,另有研究提示吉西他滨+S-1不劣效于吉西他滨+顺铂,吉西他滨+S-1和吉西他滨+顺铂的中位OS分别为15.1个月和13.4个月(HR=0.945;95%CI,0.78-1.15,非劣效性p=0.046),中位PFS分别为6.8个月和5.8个月(HR=0.86;95%CI,0.70-1.07)¹⁶。
除双联疗法外,三联疗法也逐渐成为全身治疗的重要探索方向,但目前该策略的应用尚存争议。例如,II/III期PRODIGE 38 AMEBICA试验提示,三联mFOLFIRINOX方案(5-FU+LV+奥沙利铂+伊立替康)的疗效未及双联吉西他滨+顺铂方案,两组患者的6个月PFS率分别为44.6%和47.3%,中位PFS分别为6.2个月和7.4个月,中位OS分别为11.7个月和13.8个月¹⁷。与mFOLFIRINOX方案相比,白蛋白紫杉醇+吉西他滨+顺铂或许是更有希望的探索方向。最近一项纳入38例ICC患者的单臂II期试验提示,白蛋白紫杉醇+吉西他滨+顺铂方案的中位PFS为11.8个月,中位OS为19.2个月,ICC患者的DCR为85%,PR率为55%¹⁸。值得注意的是,8例不可切ICC患者在治疗后接受了根治性手术,这提示该方案可能在缩瘤降期方面表现良好,III期随机对照SWOG1815研究正在对该方案进行进一步评估。
ICC的靶向治疗
ICC的靶向治疗正得到越来越多的关注,其中针对FGFR2和IDH1靶点已具备较为成熟的治疗策略。约10%-15%的ICC患者存在FGFR2融合,一项II期非随机研究显示,对于107例接受以吉西他滨为基础的化疗后疾病进展的FGFR2融合/重排阳性ICC患者,患者接受FGFR2抑制剂佩米替尼治疗的ORR可达36%,其中完全缓解(CR)率为3%、PR率为33%,患者的中位PFS为6.9个月,中位OS为21.1个月¹⁹。另一项研究纳入61例不可切除/转移性FGFR2融合阳性ICC患者,患者在接受以吉西他滨为基础的化疗后发生疾病进展。研究显示,患者接受FGFR2抑制剂infigratinib治疗的ORR为15%,DCR为75%,中位PFS为5.8个月²⁰。
IDH1突变约见于25%的ICC患者,既往一项纳入73例IDH1突变型胆管癌患者的I期研究显示,IDH1抑制剂艾伏尼布应用后患者中位PFS为3.8个月,中位OS为13.8个月²¹。基于这一疗效,III期随机对照ClarIDHy试验评估了艾伏尼布对比安慰剂在IDH突变型胆管癌患者中的应用,结果显示,艾伏尼布组患者的中位PFS存在显著改善(2.7个月 vs. 1.4个月;HR=0.37;95%CI,0.24-0.54;p<0.0001),中位OS存在数值上的改善,但无统计学意义(10.3个月 vs. 7.5个月;HR=0.79;95%CI,0.56-1.12;p=0.09)。特别地,该研究存在57%的患者交叉现象,在基于交叉进行调整后,安慰剂组的中位OS为5.1个月(HR=0.49;95%CI,0.34-0.70;p<0.001)²²,²³。
ICC的免疫治疗
免疫治疗近年来在多种肿瘤中大放异彩,针对ICC的部分研究提示,免疫治疗或可成为化疗难治性患者的治疗选择之一。随机、双盲、III期TOPAZ-1试验评估了吉西他滨+顺铂+
结论
ICC是一种罕见但侵袭性较强且预后较差的恶性肿瘤,其发病率正在增加。手术切除和细胞毒性治疗分别是早期ICC和晚期或转移性ICC的重要治疗手段,以此为基础的多学科治疗正显著改善ICC患者的预后情况。本文对ICC患者的药物治疗策略进行了回顾:对于局限性和可切除ICC患者,根治性手术联合术后卡培他滨辅助治疗应成为标准治疗;对于不可切除或转移性ICC患者,局部治疗、三联全身治疗、靶向治疗和免疫治疗正得到越来越多的认可,已为经过筛选的患者群体带来了令人欣喜的疗效。多项与上述疗法相关的临床研究正在进行中,期待未来这些研究结果的公布可以为ICC患者带来更多治疗获益。
参考文献:
1. Moris D, Palta M, Kim C, et al. Advances in the treatment of intrahepatic cholangiocarcinoma: An overview of the current and future therapeutic landscape for clinicians[J]. CA: A Cancer Journal for Clinicians, 2022.
2. Blechacz B, Komuta M, Roskams T, et al. Clinical diagnosis and staging of cholangiocarcinoma[J]. Nature reviews Gastroenterology & hepatology, 2011, 8(9): 512-522.
3. Rizvi S, Gores G J. Pathogenesis, diagnosis, and management of cholangiocarcinoma[J]. Gastroenterology, 2013, 145(6): 1215-1229.
4. Saha S K, Zhu A X, Fuchs C S, et al. Forty-year trends in cholangiocarcinoma incidence in the US: intrahepatic disease on the rise[J]. The oncologist, 2016, 21(5): 594-599.
5. Edeline J, Benabdelghani M, Bertaut A, et al. Gemcitabine and oxaliplatin chemotherapy or surveillance in resected biliary tract cancer (PRODIGE 12-ACCORD 18-UNICANCER GI): a randomized phase III study[J]. Journal of Clinical Oncology, 2019, 37(8): 658-667.
6. Primrose J N, Fox R P, Palmer D H, et al. Capecitabine compared with observation in resected biliary tract cancer (BILCAP): a randomised, controlled, multicentre, phase 3 study[J]. The Lancet Oncology, 2019, 20(5): 663-673.
7. Yadav S, Xie H, Bin-Riaz I, et al. Neoadjuvant vs. adjuvant chemotherapy for cholangiocarcinoma: a propensity score matched analysis[J]. European Journal of Surgical Oncology, 2019, 45(8): 1432-1438.
8. Mason M C, Massarweh N N, Tzeng C W D, et al. Time to rethink upfront surgery for resectable intrahepatic cholangiocarcinoma? Implications from the neoadjuvant experience[J]. Annals of surgical oncology, 2021, 28(11): 6725-6735.
9. Maithel, Shishir K., et al. "NEO-GAP: A phase II single-arm prospective feasibility study of neoadjuvant gemcitabine/cisplatin/nab-paclitaxel for resectable high-risk intrahepatic cholangiocarcinoma." (2022): 4097-4097.
10. Martin, Robert CG, et al. "Drug-Eluting Bead, Irinotecan Therapy of Unresectable Intrahepatic
11. Ensminger, W. D., and J. W. Gyves. "Clinical pharmacology of hepatic arterial chemotherapy." Seminars in oncology. Vol. 10. No. 2. 1983.
12. Jarnagin, W. R., et al. "Regional chemotherapy for unresectable primary liver cancer: results of a phase II clinical trial and assessment of DCE-MRI as a biomarker of survival." Annals of oncology 20.9 (2009): 1589-1595.
13. Kemeny, Nancy E., et al. "Treating primary liver cancer with hepatic arterial infusion of floxuridine and dexamethasone: does the addition of systemic bevacizumab improve results." Oncology 80.3-4 (2011): 153-159.
14. Cercek, Andrea, et al. "Assessment of hepatic arterial infusion of floxuridine in combination with systemic gemcitabine and oxaliplatin in patients with unresectable intrahepatic cholangiocarcinoma: a phase 2 clinical trial." JAMA oncology 6.1 (2020): 60-67.
15. Valle, Juan, et al. "Cisplatin plus gemcitabine versus gemcitabine for biliary tract cancer." New England Journal of Medicine 362.14 (2010): 1273-1281.
16. Morizane, C., et al. "Combination gemcitabine plus S-1 versus gemcitabine plus cisplatin for advanced/recurrent biliary tract cancer: the FUGA-BT (JCOG1113) randomized phase III clinical trial." Annals of Oncology 30.12 (2019): 1950-1958.
17. Desrame, Jérôme, et al. "Modified FOLFIRINOX versus CISGEM chemotherapy for patients with advanced biliary tract cancer (PRODIGE 38 AMEBICA): A randomized phase II study." Journal of Clinical Oncology 40.3 (2022): 262-271.
18. Shroff, Rachna T., et al. "Gemcitabine, cisplatin, and nab-paclitaxel for the treatment of advanced biliary tract cancers: a phase 2 clinical trial." JAMA oncology 5.6 (2019): 824-830.
19. Abou-Alfa, Ghassan K., et al. "Pemigatinib for previously treated, locally advanced or metastatic cholangiocarcinoma: a multicentre, open-label, phase 2 study." The Lancet Oncology 21.5 (2020): 671-684.
20. Javle, Milind, et al. "Phase II study of BGJ398 in patients with FGFR-altered advanced cholangiocarcinoma." Journal of Clinical Oncology 36.3 (2018): 276.
21. Lowery, Maeve A., et al. "Safety and activity of ivosidenib in patients with IDH1-mutant advanced cholangiocarcinoma: a phase 1 study." The lancet Gastroenterology & hepatology 4.9 (2019): 711-720.
22. Abou-Alfa, Ghassan K., et al. "Ivosidenib in IDH1-mutant, chemotherapy-refractory cholangiocarcinoma (ClarIDHy): a multicentre, randomised, double-blind, placebo-controlled, phase 3 study." The Lancet Oncology 21.6 (2020): 796-807.
23. Zhu, Andrew X., et al. "Final overall survival efficacy results of ivosidenib for patients with advanced cholangiocarcinoma with IDH1 mutation: the phase 3 randomized clinical ClarIDHy trial." JAMA oncology 7.11 (2021): 1669-1677.
24. Oh, Do-Youn, et al. "A phase 3 randomized, double-blind, placebo-controlled study of durvalumab in combination with gemcitabine plus cisplatin (GemCis) in patients (pts) with advanced biliary tract cancer (BTC): TOPAZ-1." (2022).
25. Vogel, Arndt, et al. "Regional subgroup analysis of the phase 3 TOPAZ-1 study of durvalumab (D) plus gemcitabine and cisplatin (GC) in advanced biliary tract cancer (BTC)." (2022): 4075-4075.