2023 ASCO GU | 尿路上皮癌免疫治疗重磅研究进展
2023-02-23 18:22:35来源:医脉通阅读:11次
医脉通编辑整理,未经授权请勿转载。
导读
2023年美国临床肿瘤学会泌尿男生殖系肿瘤分会(ASCO-GU)年会将于当地时间2023年2月16日至18日在旧金山盛大召开。本次大会的重磅研究摘要LBA(Late-Breaking Abstracts)部分,尿路上皮癌的免疫治疗占据近半,为临床实践提供临床依据,医脉通整理如下。
LBA440:Atezolizumab (atezo) + platinum/gemcitabine (plt/gem) vs placebo + plt/gem for first-line (1L) treatment (tx) of locally advanced or metastatic urothelial carcinoma (mUC): Final OS from the randomized Phase 3 IMvigor130 study.
LBA440:
研究背景
IMvigor130研究的初步分析表明,阿替利珠单抗+铂/吉西他滨(A组)一线治疗转移性尿路上皮癌(mUC)的PFS获益显著优于安慰剂+铂/吉西他滨(C组,Galsky Lancet 2020)。中期分析显示,与C组相比,A组患者的OS有所改善,但未超过预先指定的显著性阈值(Galsky Lancet 2020;Galsky AACR 2021)。探索性分析中,无论PD-L1状态如何,阿替利珠单抗联合
研究设计
患者按1:1:1被随机分入A组、B组(阿替利珠单抗单药)和C组。A组和C组患者接受顺铂或卡铂经由研究者评估。共同主要研究终点为无进展生存期(PFS)和总生存期(OS,A组 vs C组;B组 vs C组)。此外,研究者还报告了安全性、客观缓解率(ORR)、缓解持续时间(DOR)、疾病控制率(DCR)和预先指定的探索性OS数据。疾病控制率包括确认的完全缓解(CR)、部分缓解(PR)或疾病稳定(SD)≥6个月。

研究结果
在2022年8月31日数据截止时(最后1例患者入组49个月后),意向治疗(ITT)人群的OS获益无统计学意义(HR=0.85,95%CI 0.73,1.00;1-sided P=0.023);在顺铂亚组中,HR=0.76(95%CI 0.57,1.01)。在ITT人群中,A组的DCR为65%(290/447),C组DCR为60%(239/397)。

在安全性数据可评估的患者中,A组和C组发生3/4级治疗相关不良事件(TRAEs)的患者比例分别为81%(370/454)和80%(312/389),两组分别有9例(2%)和4例(1%)患者发生5级TRAEs。
结论
最终结果显示,与安慰剂+铂/吉西他滨相比,阿替利珠单抗+铂/吉西他滨对ITT人群的OS改善无统计学差异。从探索性数据中可以看出,顺铂亚组患者的OS获益较卡铂组更高。研究未发现新的安全性事件。
LBA441:Final overall survival (OS) analysis of atezolizumab (atezo) monotherapy vs chemotherapy (chemo) in untreated locally advanced or metastatic urothelial carcinoma (mUC) from the Phase 3 IMvigor130 study.
LBA441:阿替利珠单抗单药对比化疗一线治疗局部晚期或转移性尿路上皮癌(mUC)患者:随机3期IMvigor130研究的最终OS结果
研究背景
IMvigor 130研究的两项中期OS分析结果显示,在PD-L1高表达(IC2/3)的mUC患者中,阿替利珠单抗单药(B组)表现出较安慰剂+铂(顺铂或卡铂)具有非统计学意义的OS获益,且安全性也更好(Galsky Lancet 2020, Davis AACR 2021)。探索性数据显示,阿替利珠单抗单药在不适用顺铂的患者中(IC2/3)表现出一定的临床获益。本次大会,研究者报告了来自IMvigor 130研究A(阿替利珠单抗+铂/吉西他滨)、B、C(安慰剂+铂/吉西他滨)组的最终OS数据。
研究设计
研究整体设计见LBA440。
研究结果
在2022年8月31日数据截止时(最后1例患者入组49个月后),ITT人群OS未显示获益,但在不适用顺铂的IC2/3亚组中,患者OS获益的HR=0.56(95%CI 0.34,0.91)。

在ITT人群中,B组和C组24个月时的OS率分别为34%和32%;两组的ORR分别为24%(87/359;38%DCR)和44%(158/356;59%DCR),中位DOR分别为29.6个月和8.1个月。在不适用顺铂的IC2/3患者中,B组和C组的ORR分别为40%(20/50)和33%(14/43)。B组的中位DOR无法评估,C组的中位DOR为6.2个月。

在安全性可评估的患者中,B组和C组分别有57/354(16%)和312/389(80%)发生3/4级TRAEs ;3(1%)和4(1%)例患者发生5级TRAEs。
结论
最终分析的OS数据与此前报道的一致。阿替利珠单抗单药表现出比化疗更好的耐受性。探索性数据支持阿替利珠单抗单药作为不适用顺铂的IC2/3转移性尿路上皮癌的一线治疗。
LBA442:Pembrolizumab (pembro) monotherapy for patients (pts) with high-risk non–muscle-invasive bladder cancer (HR NMIBC) unresponsive to bacillus Calmette–Guérin (BCG): Results from cohort B of the phase 2 KEYNOTE-057 trial.
LBA442:
研究背景
虽然多数HR NMIBC对卡介苗(BCG)有反应,但无应答或肿瘤在12个月内复发的患者预后较差且需要接受根治性膀胱切除术(RC)。这项单臂、多队列、2期KEYNOTE-057研究旨在评估帕博利珠单抗单药在不适合或拒绝接受RC的、对BCG无应答的HR NMIBC患者中的疗效和安全性。队列A(原位癌±乳头样肿瘤)的结果显示,3个月时临床缓解率为41%并使得帕博利珠单抗单药方案在美国获批。此次会议,研究者报告了队列B(乳头样肿瘤不伴有原位癌)的结果。
研究设计
研究纳入了≥18岁、基线仅伴乳头样肿瘤(Ta高级别或任意级别的T1)、ECOG PS 0-2的对BCG无应答的HR NMIBC患者。患者接受帕博利珠单抗单药200mg治疗(每3周1次,≤35个周期,~2年)。如果未观察到HR NMIBC复发或疾病进展,研究者在第12周对肿瘤进行评估,此后每12周进行1次;CT尿路造影每24周做1次。队列B的主要研究重点为12个月时的无疾病生存(DFS)率和安全性,假定12个月时HR NMIBC患者的DFS率>20%。次要研究终点包括12个月时任意疾病的DFS率;至级别、分期上升或死亡的PFS;至肌层浸润、转移或死亡的PFS;OS。

研究结果
总体而言,共132例患者接受了帕博利珠单抗治疗,中位治疗周期数为9.5(范围,1.0-35.0);中位年龄为72岁(范围,37-87岁);57例(43.2%)患者为T1分期;所有患者均经组织学确认尿路上皮癌;104例(78.8%)患者为男性;患者此前接受BCG灌注的中位数为10(范围,6-33)。

中位随访时间为45.4个月(范围,14.9-77.1个月)。相应的疗效数据如下表所示。

31例(23.5%)患者在停用帕博利珠单抗之后接受了RC。97例(73.5%)患者发生了TRAEs,19例(14.4%)患者发生了3/4级TRAEs,14例(10.6%)患者因不良事件停止治疗。未发生与治疗相关的死亡。
结论
在超过45个月的随访后,帕博利珠单抗在BCG无应答的、不伴原位癌的乳头样HR NMIBC中表现出显著的抗肿瘤活性,且毒性反应可控,与队列A中保持一致,未发现新的安全性事件。研究提示,不伴原位癌的乳头样HR NMIBC且对BCG无应答、不适合或不愿接受RC的患者也可以从帕博利珠单抗单药治疗中获益。
LBA443:Extended follow-up results from the CheckMate 274 trial.
LBA443:CheckMate 274 试验的延长随访结果
研究背景
CheckMate 274研究达到了它的主要研究终点,与安慰剂相比,
研究设计
CheckMate 274研究是一项3期、双盲试验,旨在评估与安慰剂相比,纳武利尤单抗作为MIUC患者根治性切除术后辅助治疗的疗效。患者按1:1被随机分入纳武利尤单抗组(240mg,每2周1次)或安慰剂组,治疗≤1年。患者均经病理学证实高复发风险且ECOG PS≤1。主要研究终点为ITT人群和PD-L1表达≥1%人群的DFS。次要研究终点包括ITT人群和PD-L1表达≥1%人群的OS和非尿路上皮无复发生存期(NUTRFS)。探索性研究终点包括无远处转移生存期(DMFS)和安全性。

研究结果
纳武利尤单抗组纳入353例患者(PD-L1≥1%,n=140),安慰剂组纳入156例患者(PD-L1≥1%,n=142)。中位随访时间36.1个月(最小随访时间31.6个月)时,在ITT人群中,纳武利尤单抗组和安慰剂组的DFS分别为22.0个月和10.9个月(HR 0.71,95%CI 0.58-0.86);在PD-L1≥1%人群中,纳武利尤单抗组和安慰剂组的DFS分别为52.6个月和8.4个月(HR 0.52,95%CI 0.37-0.72)。
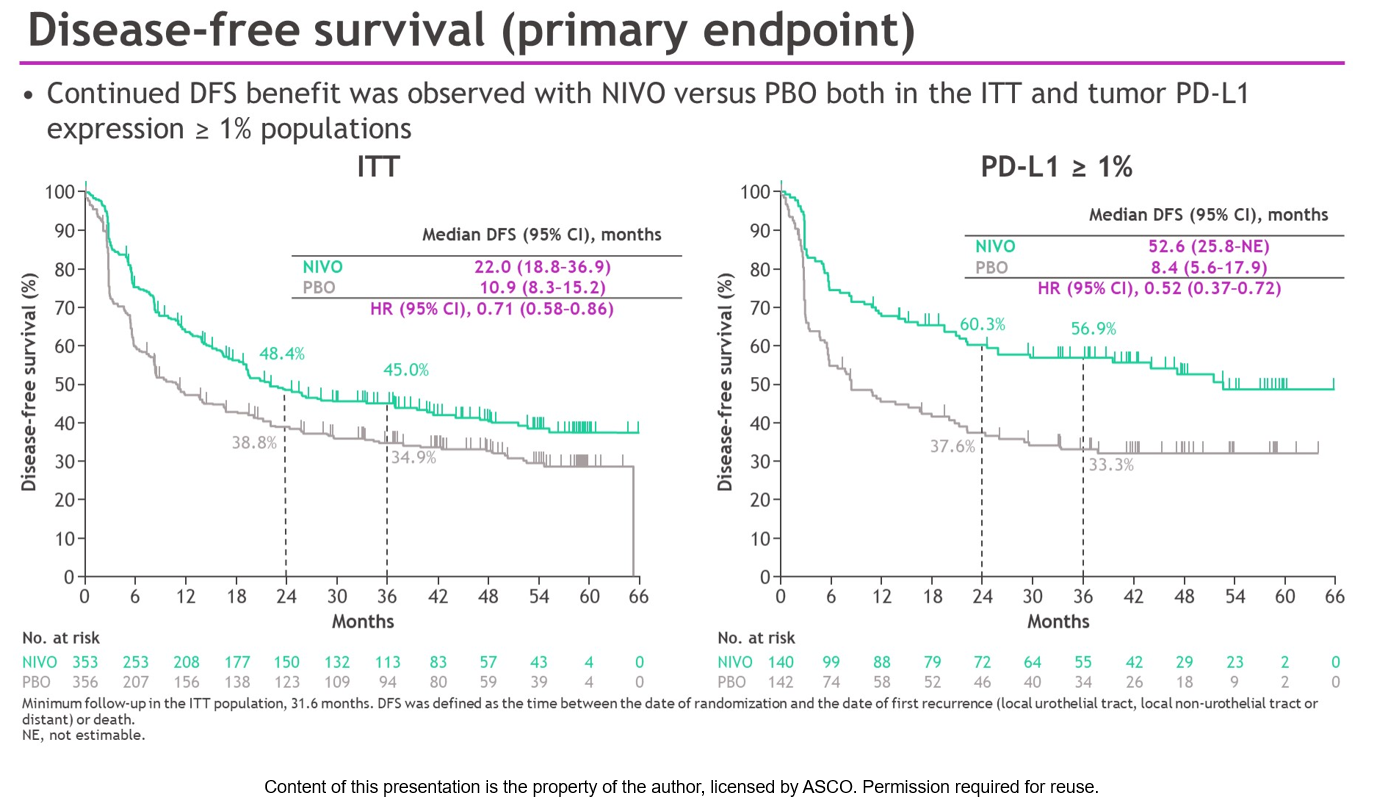
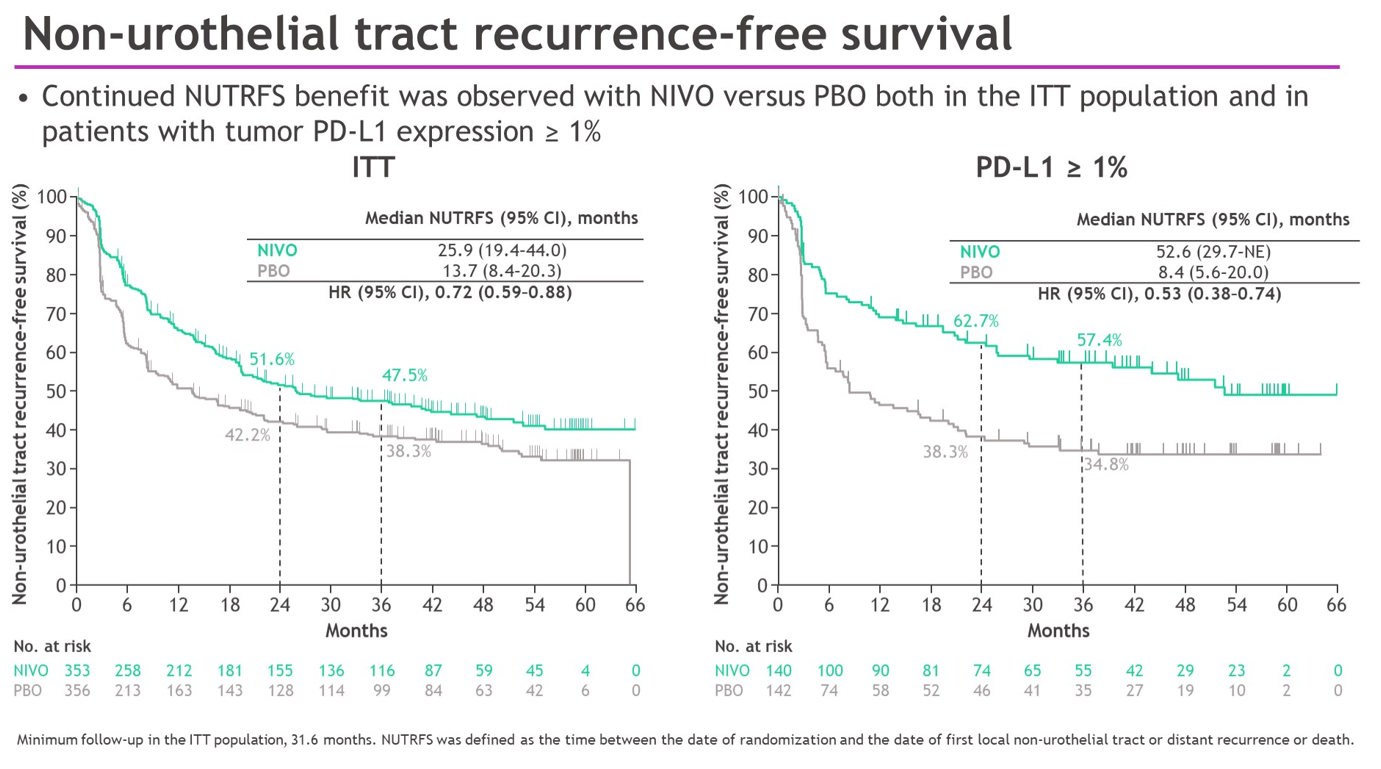
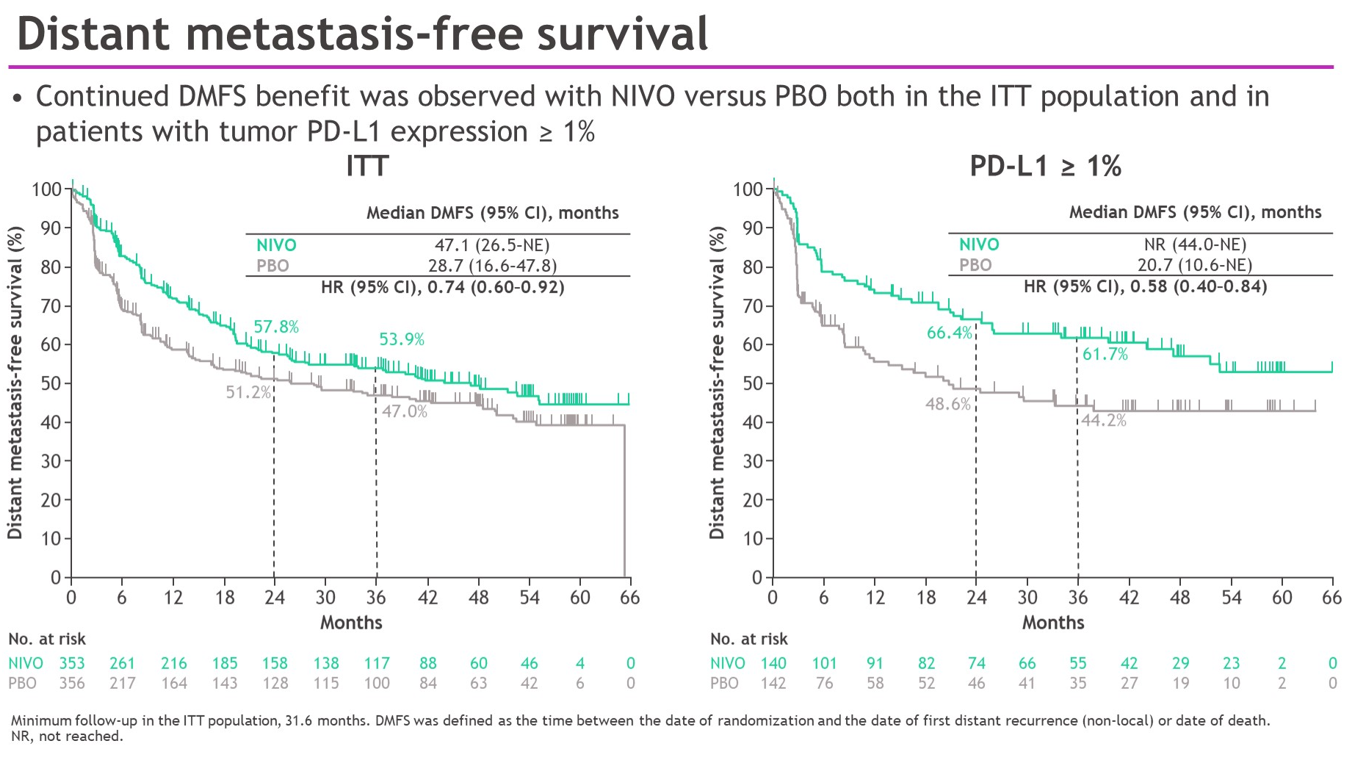
亚组分析结果显示,在包括年龄、性别、ECOG PS、淋巴结状态、接受过基于顺铂的化疗、PD-L1表达状态等亚组中,均可以看到纳武利尤单抗的获益。此外,与安慰剂相比,纳武利尤单抗在ITT人群和PD-L1≥1%人群也表现出NUTRFS和DMFS的获益。
纳武利尤单抗组和安慰剂组分别有18.2%和7.2%的患者发生了3-4级TRAEs,与初步分析时的结果一致。
结论
随着随访期延长,与安慰剂相比,纳武利尤单抗在DFS、NUTRFS和DMFS方面均有获益;PD-L1≥1%人群的DFS和NUTRFS、两组人群的DMFS,较初步分析时持续改善,且没有发现新的安全信号。以上数据进一步支持纳武利尤单抗新辅助治疗作为高危MIUC患者根治性切除术后的标准治疗方案。
参考资料
https://conferences.asco.org/gu/abstractsces.asco.org/gu/abstracts