AUA2023 重磅 | CheckMate 274研究的延长随访结果
2023-05-05 19:43:00来源:美国泌尿外科协会(AUA)年会阅读:48次
导读
一年一度的全球泌尿外科界盛会——美国泌尿外科协会(AUA)年会于当地时间4月28日至5月1日在美国芝加哥盛大召开。作为世界上最大、最具影响力的泌尿外科学术会议,AUA年会汇聚了世界各地泌尿领域的开拓性研究、新指南及泌尿医学最新进展。CheckMate 274研究是一项III期随机双盲试验,用于评估纳武利尤单抗在根治性切除术后高危肌层浸润性尿路上皮癌患者中的疗效。本次大会公布了该研究的延长随访结果,医脉通整理如下,以飨读者。
摘要号:LBA02-08
标题:RESULTS FROM THE EXTENDED FOLLOW-UP IN PATIENTS WITH MUSCLE-INVASIVE BLADDER CANCER IN THE CHeckMATE 274 TRIAL
第一作者:Matthew Milowsk
研究背景
尽管进行了根治性手术,肌层浸润性尿路上皮癌(MIUC)患者仍存在着致命的转移复发高风险,多数患者会在术后2-3年内复发。既往公布的CheckMate 274研究达到了它的主要研究终点,与安慰剂相比,纳武利尤单抗改善了意向治疗(ITT)人群和PD-L1表达≥1%人群的无疾病生存期(DFS),基于这一结果,纳武利尤单抗成为了MIUC的标准治疗方案。本次大会,研究者报告了该研究的延长随访结果。
研究设计
患者按1:1被随机分配至纳武利尤单抗组(240mg,每2周1次)或安慰剂组,接受≤1年的治疗,并根据淋巴结状态、、PD-L1表达状态及既往是否接受以顺铂为基础的新辅助化疗进行分层。患者均经病理学证实高复发风险且ECOG PS≤1。主要研究终点为ITT人群和PD-L1表达≥1%人群的DFS。次要研究终点包括ITT人群和PD-L1表达≥1%人群的OS和非尿路上皮无复发生存期(NUTRFS)。探索性研究终点包括无远处转移生存期(DMFS)和安全性。
研究结果
共纳入709例患者,其中560例肌层浸润性膀胱癌(MIBC)患者分别接受纳武利尤单抗(n=279)及安慰剂(n=281)治疗。中位随访时间36.1个月(最小随访时间31.6个月)时,与安慰剂相比,接受纳武利尤单抗治疗的ITT(HR 0.71,95%CI 0.58-0.86)及MIBC(HR 0.63,95%CI 0.51-0.78)人群的DFS均显著获益。

图1 患者的一般情况及疾病特征

图2 与安慰剂相比,接受纳武利尤单抗治疗的ITT及MIBC人群的DFS均显著获益
在PD-L1表达≥1%的总体人群和MIBC人群中,与安慰剂相比,接受纳武利尤单抗治疗的患者的DFS均显著提升(总体人群:HR 0.52,95%CI 0.37-0.72;MIBC人群:HR 0.44,95%CI 0.30-0.63)。这一获益趋势在PD-L1表达<1%的患者中也得到体现(HR 0.74,95%CI 0.56-0.97)。
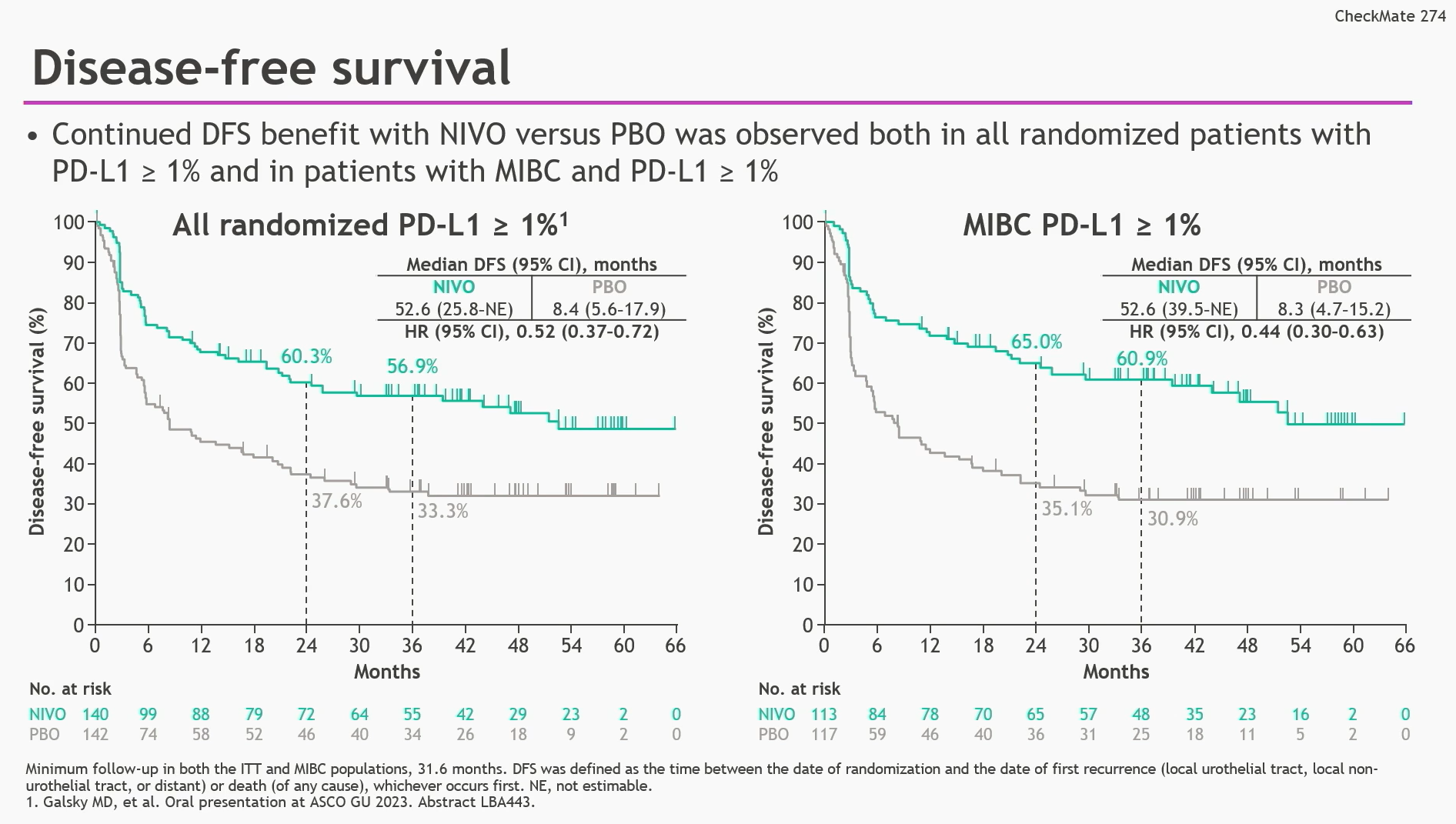
图3 与安慰剂相比,接受纳武利尤单抗治疗的PD-L1表达≥1%的总体人群及MIBC人群的DFS均显著获益
此外,与安慰剂相比,纳武利尤单抗在ITT人群和MIBC人群也表现出NUTRFS(ITT人群:HR 0.72,95%CI 0.59-0.88;MIBC人群:HR 0.64,95%CI 0.52-0.80)和DMFS(ITT人群:HR 0.74,95%CI 0.60-0.92;MIBC人群:HR 0.70,95%CI 0.55-0.89)的获益。
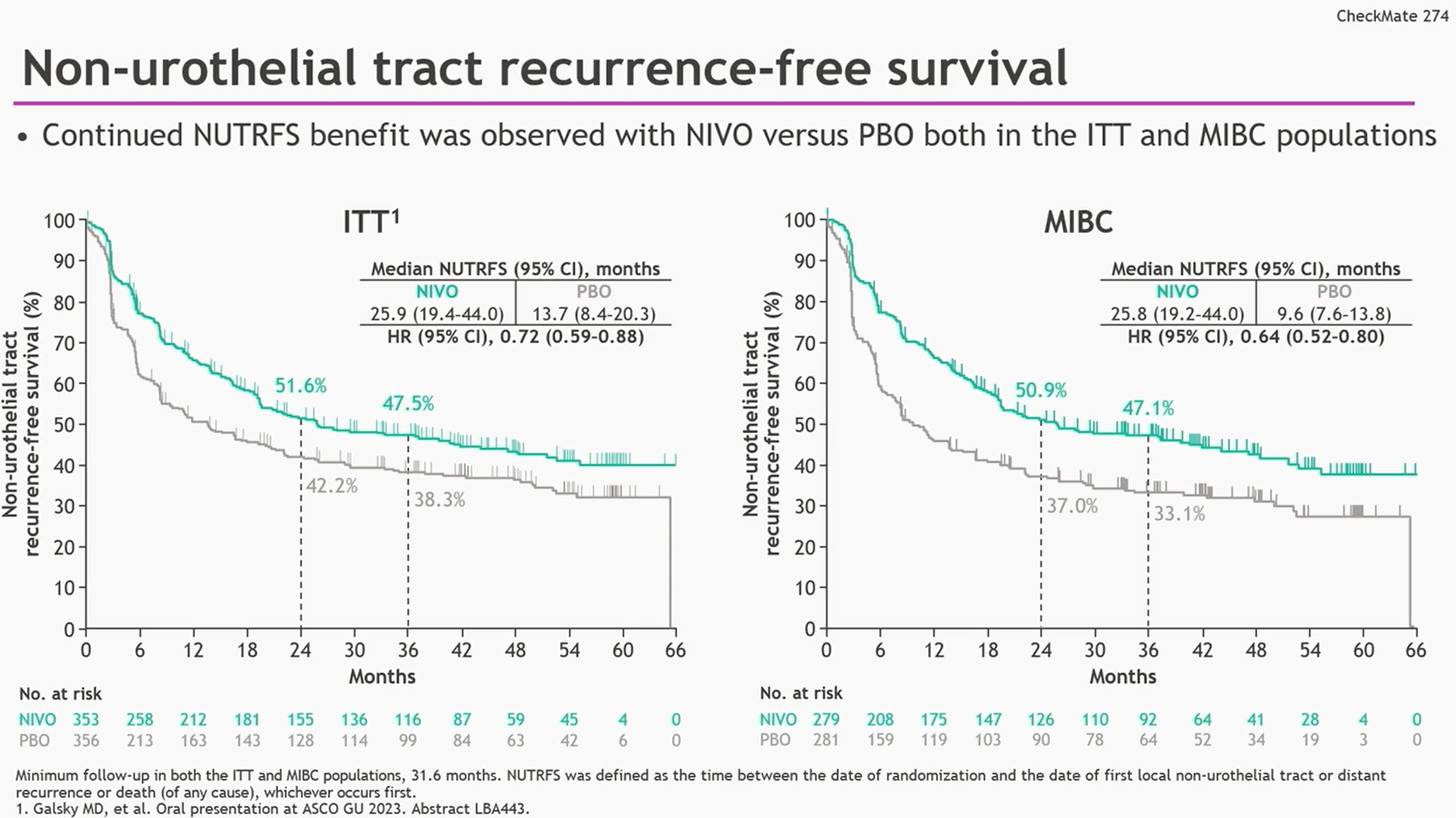
图4 与安慰剂相比,接受纳武利尤单抗治疗的ITT人群及MIBC人群的NUTRFS均获益
纳武利尤单抗组和安慰剂组分别有17.3%和5.8%的患者发生3/4级治疗相关不良事件(TRAEs)。
结论
随着随访期的延长,与安慰剂相比,纳武利尤单抗在ITT人群及MIBC人群中均有DFS、NUTRFS和DMFS方面的获益,且DFS的获益与PD-L1表达状态无关。纳武利尤单抗在MIBC人群的安全性与既往数据一致,未发现新的安全信号。以上数据进一步支持纳武利尤单抗作为高危MIUC及MIBC患者根治性切除术后的标准治疗方案。
参考资料:
https://www.auajournals.org/toc/juro/209/Supplement+4