中国肾脏移植组织配型临床诊疗指南
中华医学会器官移植学分会
【摘要】 组织配型是影响肾脏移植成功的关键因素之一。我国目前肾脏移植发展的主要目标是提升移植肾术后长期存活。组织配型技术的快速发展,尤其是人类白细胞抗原(human leucocyte antigen, HLA)高分辨分型方法和等位基因特异性抗HLA抗体的检测技术,推动了肾脏移植供受者选择达到更为精准的层面,促进了器官分配的科学发展,为肾脏移植受者个体化精准免疫抑制治疗奠定了基础。肾脏移植术前推广组织配型,有助于提高受者和移植肾脏长期存活的目标,是精准医学在肾脏移植领域应用的体现。
基金项目:国家自然科学基金(82370755,82170768);陕西省科技厅两链融合项目(2021LL-JB-06(3.4);白求恩公益基金会共享阳光重大疾病临床科研合作项目G-X-2019-0101;广东特支计划”卫生健康领域领军人才项目(R09002)。
Abstract: Tissue matching is one of the key factors affecting the success of kidney transplantation. At present, the main goal of the development of kidney transplantation in China is to improve the long-term survival after kidney transplantation. The rapid development of tissue matching technology, especially the high-resolution typing method of human leucocyte antigen (HLA) and the detection technology of allele-specific anti-HLA antibodies, promoted the selection of donors and recipients for kidney transplantation to a more accurate level, and promoted the scientific development of organ allocation. It lays a foundation for individualized and precise immunosuppressive therapy for kidney transplant recipients. The promotion of tissue matching before kidney transplantation helps to improve the long-term survival of recipients and transplanted kidneys, which is the embodiment of the application of precision medicine in the field of kidney transplantation.
Key words: Kidney transplants, Tissue matching, Human leucocyte antigen
Funding program: National Natural Science Foundation of China, 82370755, 82170768; Two-chain Integration Project of Science and Technology Department of Shaanxi Province [2021LL-JB-06 (3.4)]; Bethune Public Welfare Foundation shares the Sunshine Major Diseases Clinical research cooperation project (G-X-2019-0101); Elite Talent Project of Guangdong Province (R09002).
肾脏移植是终末期肾病最有效的治疗方法,目前短期存活理想,但移植肾10年存活率不足50%[1]。大量临床研究证明移植肾长期存活最主要的影响因素是供者特异性抗体(donor specific antibody, DSA)介导的排斥反应[2]。DSA的主要成分是抗供者人类白细胞抗原(human leukocyte antigen, HLA)的抗体[3]。移植受者HLA抗体的产生来源于对供者(或其它来源,如输血、感染交叉反应等)同种异体HLA产生的免疫应答。因此供受者HLA的分型、受者HLA抗体的检测和特异性分析对于DSA的判别,排斥反应风险的评估和分层,指导抗体介导排斥反应(antibodies mediate rejection, ABMR)的预防和治疗具有基础性的重要作用。近年来我国各移植中心实验室组织配型技术及应用情况发展不一,各实验室检测体系和评判标准存在差异,临床医师对检测结果的临床意义理解存在不同,对于肾脏移植前是否进行组织配型以及组织配型的内容存在诸多争议。因此有必要针对组织配型内容,组织配型技术,实验室检测体系和评判标准,检测结果的临床意义及解读等问题,基于当前可以获得的最佳证据,明确证据质量和推荐强度,以临床实践和应用为导向,开展《中国肾脏移植组织配型临床诊疗指南》的制定工作。
一、指南形成方法
本指南已在国际实践指南注册与透明化平台(Practice Guide Registration for TransPAREncy, PREPARE)上以中英双语注册(注册号:PREPARE2023CN831)。
临床问题的遴选及确定:工作组对国内外该领域发表的指南和共识进行比对,针对既往指南中没有涉及和有研究进展的内容及临床医生重点关注的内容,初步形成20个临床问题。经过问卷调查和专家组会议讨论,对临床关注的问题进行讨论,最终形成本指南覆盖的15个临床问题,涉及组织配型实验室检测和临床应用两大方面。
证据检索与筛选:证据评价组按照人群、干预、对照、结局(population,intervention,comparison,outcome,PICO)的原则对纳入的临床问题进行检索,检索MEDLINE(PubMed)、Web of Science、万方知识数据服务平台和中国知网数据库,纳入指南、共识、规范、系统评价和meta分析、队列研究、病例对照研究等观察性研究;检索词包括:“肾脏移植”、“组织配型”、“HLA”、“DSA”、“致敏因素”、“免疫风险分层”、“校准群体反应抗体”、“非HLA抗体”、“错配”、“肾脏移植长期存活”和“肾脏移植排斥反应”等。文献检索时间为1964年1月至2023年10月。完成证据检索后,每个临床问题均由共识专家组成员按照题目、摘要和全文的顺序逐级独立筛选文献,确定纳入符合具体临床问题的文献,完成筛选后两人进行核对,如存在分歧,则通过共同讨论或咨询第三方协商确定。
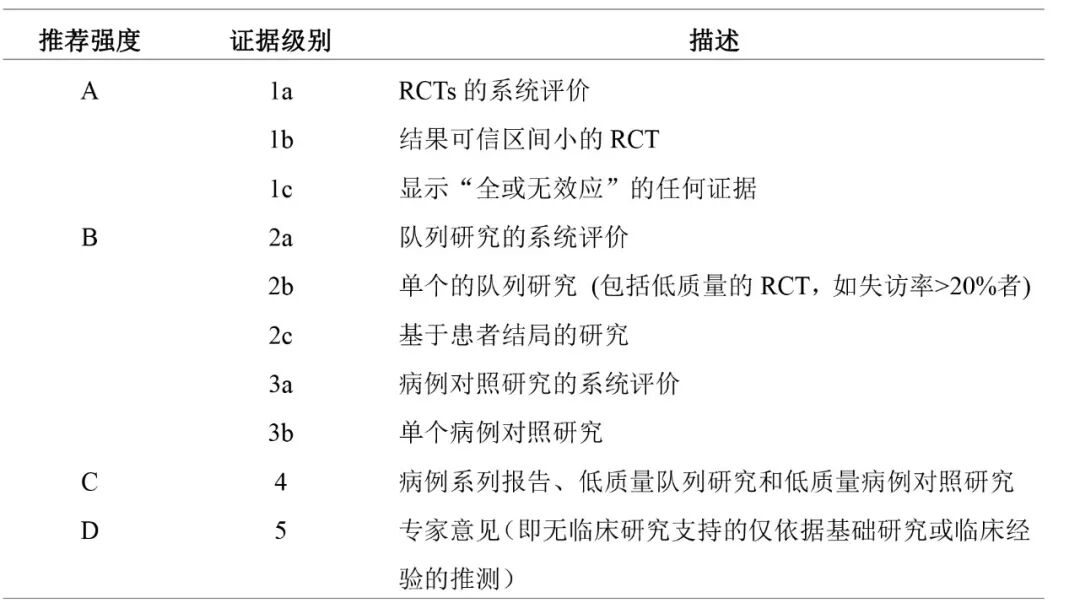
证据分级和推荐强度分级:本指南使用2009版牛津大学循证医学中心的证据分级与推荐强度标准对每个临床问题的证据质量和推荐强度进行分级(表1)。
表 1 证据质量与推荐强度分级
推荐意见的形成:综合考虑证据以及我国患者的偏好与价值观、干预措施的成本和利弊等因素后,指南工作组提出了符合我国临床诊疗实践的21条推荐意见。推荐意见达成共识后,工作组完成初稿的撰写,并提交外审组专家进行审阅,根据其反馈意见对初稿进行修改,最终形成指南终稿。
二、肾脏移植组织配型的临床意义
临床问题1:肾脏移植供受者术前组织配型包括哪些内容,是否有必要进行组织配型?
推荐意见1:肾脏移植组织配型包括:ABO血型鉴定、HLA匹配、群体反应性抗体检测和淋巴细胞毒性交叉试验。供受者组织配型可以通过:降低HLA错配负荷,评估受者免疫风险,指导致敏受者选择合理的临床路径并评估治疗效果,指导术后受者个体化免疫抑制治疗等,减少排斥反应的发生,提高移植物存活时间,因此推荐肾脏移植供受者术前进行组织配型(推荐强度B,证据等级2a)。
人类器官移植的成功起始于免疫学的突破,认识到HLA系统的高度多态性,其造成的供受者差异是移植的天然免疫屏障。同卵双胞胎之间肾脏移植的成功提示了组织配型对移植的重要作用[4]。之后的60年中,很多新型强效的免疫抑制剂研发成功并进入临床,得到了良好的效果,甚至配型欠佳的肾脏移植也能够获得满意的短期生存率[5]。因此组织配型未受到足够重视,其技术很长时间停留在血清学和细胞学的水平。近年来,肾脏移植临床长期的观察总结发现,尽管免疫抑制剂越来越高效低毒,但是移植肾的长期生存率却停留在一个相对固定的水平,很难突破[6]。
组织配型包括ABO血型的配合、HLA匹配、群体反应性抗体(panel reaction antibody, PRA)的检测和淋巴毒交叉配型,而HLA匹配是整个组织配型的基石。HLA-A,B,DR三位点抗原错配的数量是衡量供受者HLA匹配程度的传统标准,错配数目的增加导致较低的移植肾生存率[7-8]。国内外大量的研究结果表明,HLA匹配和器官移植效果之间存在着非常密切的关系[7]。德国专家对欧州4万多例遗体肾脏移植分析,1~5年存活率随HLA匹配错配数的增加而降低,首次移植患者0~1个抗原错配组比HLA匹配较差组1年存活率提高6%~8%,10年存活率提高10%[8]。我国也有研究者对此进行分析,得出了相似的结论[9]。因此,HLA匹配对于肾脏移植具有重要作用。
早在上世纪60—80年代,供受者之间的HLA匹配就被发现与更好的移植效果和患者生存率有关[10]。I类HLA-A和-B抗原的匹配影响生存,但II类HLA-DR抗原的匹配被证明影响最大[11]。大数据集和国内外数据库的分析表明,HLA匹配对移植物存活有益[12]。
在具有供受者HLA高分辨分型结果的基础上,通过最新的分子配型计算机程序工具,可以对HLA错配负荷进行评估,包括功能表位(eplet)错配分析、预测间接可识别的HLA II类表位(predicted indirectly recognizable HLA epitopes II, PIRCHE II)评分、三维静电荷错配评分(three-dimensional electrostatic mismatch score, EMS-3D)和氨基酸错配评分(amino acid mismatch score, AMS)[13]。其中eplet分析从供受者错配的B淋巴细胞抗原表位的数量,预测供者HLA对于受者的免疫原性大小。目前多项临床研究证实,eplet错配数与受者术后新生供者特异性抗体(de novo donor specific antiboy, dnDSA)、移植物肾小球病、抗体介导排斥反应(antibody mediated rejection, ABMR)等有明显的相关性,相对于HLA血清学抗原错配数能够更加精确地反映同种异体免疫反应风险[14]。进行器官分配时,通过合理供受者匹配减少eplet错配数,是减少术后发生排斥反应风险、提高长期生存率的理性选择[15-16]。
受者在肾脏移植以前,如有接触非己HLA的历史,就有可能产生免疫反应,即有HLA预致敏史。受者HLA抗体检测阳性是HLA预致敏的证据(请注意:阴性结果不能完全排除预致敏)。体内存在HLA抗体的患者被认为处于致敏状态,尤其是存在高水平DSA。PRA超过20%为致敏,达到80%以上为高致敏,是目前普遍认可的标准。2009年UNOS开始采用cPRA来评估受者的致敏程度。cPRA是针对目标人群的HLA频率,计算供者HLA不能被致敏受者接受的百分比。美国器官获取和移植网络(Organ Procurement and Transplantation Network, OPTN)把高致敏定义为cPRA达到98%~100%[17]。欧洲移植肾脏分配系统自1980年开始采用虚拟PRA(virtual PRA, vPRA),其计算方式近似于cPRA [18]。研究发现,vPRA和pPRA[(peak PRA, pPRA),等待移植患者所有PRA检测中,比值最高的一次PRA] 均为评估移植物致敏作用和预测移植物长期生存提供了可靠的方法。cPRA或vPRA可能是量化致敏程度最客观的参数[19]。预存DSA (preformed DSA, pfDSA) 的平均荧光强度(mean fluorescence intensity, MFI)值越高,移植术后发生ABMR的风险越高[20]。
移植前脱敏治疗方法包括免疫吸附,血浆置换以及B细胞清除等方法,在许多中心显示出良好的结果[21-22]。检测受者外周血HLA抗体是指导脱敏治疗的依据,也是评估治疗效果的最有效且快捷的方法之一。根据脱敏治疗前,治疗后患者HLA抗体水平,可以评估脱敏治疗方法是否有效,从而选择最有效的脱敏手段进行个体化脱敏治疗。
致敏受者携带有HLA抗体,存在对HLA的免疫记忆。首先需要通过其抗体谱的宽窄和强度评估肾脏移植的难易程度,决定是否需要进行脱敏治疗。对于近期发生过同种异体致敏事件的患者,特别是再次或多次肾脏移植患者(例如免疫抑制剂做过调整),非常有必要采用致敏受者移植术前24小时内的血清进行前瞻性的移植前供受者淋巴细胞交叉配型(crossmatch, XM)。另外,虚拟交叉配型 (virtual crossmatch, VXM)是基于受者当前和/或既往的抗体检测结果与潜在供者 HLA 高分辨分型,评估供受者免疫相容性[23]。cPRA高的受者,获得可接受供肾的机会小,需要通过脱敏治疗并放宽对“不可接受错配”的限制方能增加移植机会。而cPRA低的受者,则不必进行脱敏治疗,可通过VXM避开致敏HLA,获得移植机会。对于“不可接受错配”阈值放宽的致敏受者,应适当增加免疫抑制强度,而“不可接受错配”HLA标准严格的受者,其ABMR的风险与非致敏受者基本一致,不必增加免疫抑制强度[24]。
肾脏移植供受者HLA匹配、受者HLA 致敏史(如妊娠、既往移植、输血等)和HLA抗体检测的结果是对受者进行免疫风险分层的主要依据和个体化免疫抑制治疗的重要参考[25]。免疫风险是对受者免疫抑制最低“有效”剂量的估算依据,感染风险则是对免疫抑制最高“安全”剂量的限制标准,二者之间是免疫抑制个体化的“安全有效”治疗窗口。对肾脏移植受者个体而言,感染风险主要由自身因素决定,是相对固定的,因此通过免疫风险的分层准确把握受者的最低有效剂量,是个体化免疫抑制剂治疗中的关键控制因素。术前供受匹配越接近,对免疫风险的评估越准确,则对术后免疫抑制治疗的强度要求越低,治疗效果越好。
三、肾脏移植供受者HLA分型技术
临床问题2:肾脏移植供受者HLA分型技术有哪些,如何选择?
推荐意见2:常用HLA分型技术包括:序列特异性引物法、序列特异性寡核苷酸探针法、基因测序法、下一代基因测序法等。对于死亡器官捐献者和所有等待肾脏移植受者推荐进行HLA-A,B,C,DRB1,DQB1,DPB1,DQA1,DPA1及DR345高分辨基因分型(推荐强度B,证据等级2b)。
推荐意见3:死亡器官捐献者根据获取时间的紧迫性,可以先进行HLA-A,B,DR,DQ中低分辨基因分型,后续再进行高分辨基因分型,为分析肾脏移植受者是否存在pfDSA或术后产生dnDSA提供诊断和治疗依据(推荐强度B,证据等级2a)。
常用HLA 分型方法,包括序列特异性引物(sequence specific primer, SSP)法、序列特异性寡核苷酸探针(sequence specific oligonucleotide probes, SSOP)法、基因测序分型(sequencing based typing, SBT)、二代测序(next generation sequencing, NGS)法等。从对HLA等位基因的分辨水平可分为低分辨分型、中分辨分型和高分辨分型[26]。
(1)SSP方法:SSP方法的原理是根据已知HLA序列设计特异性引物进行聚合酶链(polymerase chain reaction, PCR)反应,通过特异性引物与模板DNA互补形成的PCR产物片段大小,判断HLA各位点的基因型。实验操作相对较简便,分型结果需要人工判断,分型结果常为低分辨率水平的血清型分型结果[27]。
(2)SSOP方法:SSOP方法的原理是在磁珠上包被基于已知HLA序列设计的寡核苷酸探针,再将标记上荧光信号的待检DNA片段反向与探针杂交,通过红绿激光荧光类型和强度来确定其基因型。该方法进行HLA基因分型为低或中分辨率水平,实验操作相对简便,分析数据时间较短约4~6小时内完成。但存在结果判断错误,及分辨率较低,存在模棱两可等位基因组合较多的问题[28]。
上述两种方法,因分辨率低已逐渐不能满足临床肾脏移植的需要,但是在目前的器官捐献条件下,大多数移植配型实验室受时间、人员和设备条件的限制仍在采用该实验方法,将分配器官前供者HLA分型资料上传中国人体器官分配与共享计算机系统(China Organ Transplant Response System, COTRS)。
(3)SBT方法:SBT方法的原理为双脱氧终止法(又称Sanger测序法),是HLA基因分型检测的金标准,其针对HLA不同位点关键外显子区域进行DNA片段扩增,经PCR扩增后的产物进行测序反应,得到HLA高分辨分型结果,该方法实验操作复杂,约12~16小时内完成,适用于等待肾脏移植患者、非紧急状态下器官捐献者进行HLA-A,B,C,DRB,DQB1五个位点10个等位基因分型,可准确反应上述位点关键氨基酸序列[29]。
(4)NGS方法:NGS方法的原理为大规模平行测序,可覆盖数百万个DNA片段的全外显子测序,需要约4~5天完成整个实验步骤,具有分辨率高、准确分型、覆盖位点更广的优势。除可检测经典HLA-A,B,C,DRB1,DQB1,DPB1,DPA1,DQA1,DRB345位点外,还可以检测非经典HLA-E,F,G,H位点,及MICA、MICB位点的等位基因分型结果,98%以上的上报结果为该位点核苷酸序列的唯一等位基因型。适用于确定的捐献者、亲属活体器官捐献者,和所有等待肾脏移植受者,及样本量较大的机构开展HLA基因分型[30]。
肾脏移植术后受者产生的抗HLA抗体,与供受者HLA基因错配密切相关。采用供受者HLA-A,B,C,DRB1,DQB1,DPB1,DQA1,DPA1及DR345各位点高分辨基因分型有以下临床优势:在供受者选择中,判断等位基因是否相合以及进行HLA抗原表位分析;当受者有预存抗HLA抗体,可准确预测供者是否存在不可接受错配的HLA位点,避免引发移植后超急性排斥反应的发生,如供者携带强交叉反应组的抗原类型时,需要移植后增加检测HLA抗体的频率;对移植后进行dnDSA和非供者特异性抗体(non donor specific antibody, NDSA)结果的分析和判断。从而为临床移植物长期功能的评估、诊断ABMR提供实验和理论依据[31-32]。
因此,美国组织相容性和免疫遗传学会(American Society for Histocompatibility and ImmunoGenetics, ASHI)在2023年版的标准中明确提出对于器官捐献者HLA分型的要求:对于潜在活体供肾者必须检测HLA-A,B(Bw4/Bw6),DRB1分型,推荐进行HLA-C,DRB3,DRB4,DRB5,DQA1,DQB1,DPA1,DPB1分型,其中Bw4/Bw6需要根据B位点结果进行分析,并在HLA基因分型报告中注明[33];对于死亡器官捐献者必须是在分子水平检测 HLA-A,B(Bw4/Bw6),C,DR(DR51/52/53),DQA1,DQB1,DPB1基因分型,并在报告中标明抗原型,其中Bw4/Bw6,DRB3,DRB4,DRB5需要根据B和DR位点结果进行分析;所有捐献者HLA分型结果需要上传器官获取组织(Organ Procurement Organization, OPO)组织,以此判断患者和捐献者HLA基因型、抗原型的相合度。
肾脏移植供受者应检测更多的HLA位点,其临床意义可以归纳为以下几个重要方面:
(1)应用供受者HLA基因分型结果不仅能判断HLA的错配位点,还能根据错配位点分析HLA抗体是否为DSA和NDSA的重要证据。
(2)在HLA的错配位点中HLA-II类分子中DR,DQ;HLA-I类分子中A,B是应重点分析位点,现有文献报告在肾脏移植术后新生HLA抗体类型中最多频率为HLA-DQ,A,DR,B,C,DP。
(3)HLA位点共处区段和等位基因间强连锁,是决定共同抗原表位及交叉反应组的重要依据。不仅HLA位点间存在强连锁,而且不同HLA位点在6号染色体上所处于区段不同,其中HLA-DR和DQ共处于Delta区段;HLA-B、C共处于beta区段;HLA-A、H、G共处于alpha区段、HLA-DPB1、DPA1共处于epsilon区段。
(4)HLA抗体检测试剂中对于HLA-II类分子包被为α链和β链组成抗原。如HLA-DQ位点中α链和β链分别由DQA1和DQB1基因所编码组成抗原分子,并且DQA1和DQB1等位基因为强连锁,如DQA1*03:02与DQB1*03:03强连锁,在HLA抗体检测中决定抗原类型为DQ9。实验研究和临床诊疗均已明确无论是移植前预存HLA抗体,还是移植后新生HLA抗体,尤其是dnDSA,与肾脏移植术后急性、慢性排斥反应的发生,移植物长期带肾存活功能均密切相关。因此,HLA作为最重要的移植物抗原,精准HLA分型检测结果有利于提高移植肾功能的长期使用。
推荐意见4:HLA基因分型的质量控制至少包括:建立规范化的HLA分型技术平台;正确的性能验证和性能确定实施方案,对实验人员进行相关培训和考核;建立样本接收和拒收,样本处理的标准操作程序;建立试剂、关键耗材、仪器维护和校准、数据分析、数据库更新;建立结果复核、结果报告、报告解读、报告发布质量控制管理程序文件;建立室内质量控制规则,制定能力验证或室间质评计划;要求结果报告内容清晰规范,临床解读科学严谨(推荐强度D,证据等级5)。
HLA具有复杂的等位基因多态性、种族差异性。分型技术的选择、结果分析和判读、环境、人员资质等因素,都可能会影响HLA基因分型检测结果的准确性。HLA分型的质量控制包括HLA基因分型检测前,检测过程中和检测后三部分[34]。
HLA基因分型检测前的质量控制应包括:建立标本采集、暂存、运输、接收、验收的质量管理程序文件,提供标本采集和项目手册,对关键环节设立质量目标、质量指标;建立不同样本接收和拒收标准及标本前处理的标准操作程序(standard operating procedure, SOP)文件;样本的识别性、唯一性、溯源性、安全性等内容的风险评估是检验前质量管理的重点,以及应监控纠正措施和持续改进的效果。检测申请单的设置可由临床或协议单位共同参与完成,并需要定期评估申请单的适用性。
HLA基因分型检测过程中的质量控制应包括:建立试剂和关键耗材的质量控制规则、仪器维护和校准的质量控制规则、制定室内质量控制规则、制定参加能力验证或室间质评计划;制定数据分析的质量控制流程及质控指标、制定对于不能确定HLA等位基因分型结果的分析和复核的质量控制流程。
HLA基因分型检测后的质量控制应包括:制定结果复核的质量控制规则、制定检验后样本的保存和使用规则;制定HLA基因分型结果报告,报告解读,报告发布的质量控制规则;制定HLA分析专用软件版本的更新和验证,HLA数据库的更新和验证的质量控制规则;制定信息系统包括本地和异地数据备份和验证,保护数据安全性,人员授权和职责等的质量控制规则;制定患者和捐献者隐私保密等内容的质量控制规则。
四、肾脏移植供受者HLA匹配度的分析方法
临床问题4:如何选择肾脏移植供受者HLA匹配位点?
推荐意见5:肾脏移植术后排斥反应与供受者HLA-A,B,DR,DQ,C,DP位点匹配程度密切相关。因此推荐肾脏移植供受者进行HLA-A,B,DR,DQ位点匹配(推荐强度B,证据等级2a)。
推荐意见6:鉴于其他抗原匹配可能对移植肾排斥反应及长期存活的影响,建议有条件的中心增加HLA-C,DP,DR345位点的匹配(推荐强度B,证据等级2b)。
HLA位于人类6号染色体短臂的21.31区域,由一组紧密连锁的基因群组成,具有结构复杂、多基因性、高度多态性、单体型遗传、连锁不平衡等特征[35]。与医学免疫,特别是移植免疫相关的HLA复合体,包括经典HLA‑Ⅰ类基因座位HLA‑A,B,C;经典HLA‑Ⅱ类基因座位HLA‑DR,DQ,DP;非经典HLA‑Ⅰ类基因座位HLA‑E,F,G;炎症相关基因(如MHC-Ⅰ类链相关基因A(MHC-class Ⅰ chain related genes A, MICA)、MHC-Ⅰ类链相关基因B(MHC-class Ⅰ chain related genes B, MICB));补体成分编码基因(如C2,C4A)等[36]。HLA具有极为复杂的等位基因多态性和抗原表型,至 2021年4月最新的国际免疫遗传学(International Immunogenetics, IMGT)数据库3.44版本中报道[37]。
早在上世纪80年代,供受者之间的HLA匹配就被发现与更好的移植和患者生存有关[38]。在HLA的错配位点中HLA-II类分子中DR,DQ;HLA-I类分子中A,B是应重点分析位点,现有文献报告在肾脏移植术后新生HLA抗体类型中最多频率为HLA-DQ,A,DR,B,C,DP。I类HLA-A和HLA-B抗原的匹配影响生存,但II类HLA-DR,DQ抗原的匹配被证明具有最强大的作用[38-39]。在大型数据集和国际数据库的分析中,证明了HLA匹配对移植物存活的有益影响[40]。
临床问题5:分析肾脏移植供受者HLA匹配程度的方法有那些,如何选择?
推荐意见7:目前常见供受者匹配方法包括基于HLA低分辨分型的全抗原匹配方法(HLA抗原位点匹配、HLA氨基酸残基匹配)和基于HLA高分辨分型的分子匹配方法(HLA功能表位匹配、HLA PIRCHE II匹配、HLA三维静电匹配及HLA氨基酸序列匹配)。HLA匹配方法和产生的结果之间具有相关性,目前HLA抗原位点匹配、HLA氨基酸残基匹配、HLA功能表位匹配较为常用。推荐移植中心可根据对HLA匹配方法的熟悉性和可操作性选择采用,无论采用哪一种匹配方法,都是遵循少错配的原则(推荐强度B,证据等级2a)。
供受者HLA匹配随着HLA高分辨分型方法的出现,HLA匹配技术也得到了迅速的发展。HLA抗原位点匹配和HLA氨基酸残基匹配是基于供受者HLA血清型或中低分辨基因分型结果。HLA功能表位匹配、HLA PIRCHE II匹配、HLA三维静电匹配及HLA氨基酸序列匹配是基于供受者HLA高分辨基因分型结果基础上的匹配方法[41]。
确定移植供受者HLA相匹配的标准是组织、器官移植的基础。OPTN下属的美国器官资源共享网络(United Network for Organ Sharing, UNOS)制定了国际上通用的HLA-A,B,DR位点无错配标准(zero HLA-A,B,DR antigen mismatch, 0 Ag MM)。尽管按0 Ag MM标准选择供、受者的肾脏移植获得了较为理想的1、5、10、20年肾存活率,但鉴于HLA系统的高度多态性,要寻找到HLA相匹配的供受者,就必须增加受者或供者的样本量。由于供者的HLA型别是随机的,HLA匹配率的大小在很大程度上取决于受者样本量的大小。由于各移植中心受者的样本池相对较小,达到0 Ag MM标准的肾脏移植比例更低。因此,在我国0 Ag MM标准的临床应用,受到很大的限制。
鉴于HLA六抗原配型标准的临床实际应用受到诸多客观条件的限制,寻找更为实用、临床可行的配型策略成为移植免疫学者、组织配型专家和临床医师共同关注的重要课题。早在20世纪90年代初期,许多学者的临床回顾性分析发现,同样是供受者的HLA错配,有些错配明显影响存活率,而有些错配并无明显影响甚至有益,因此,提出所谓“有益错配、中性错配和有害错配”之分的假设。
1996年3月,Terasaki领导的世界著名的美国加州大学洛杉矶分校(University Of California, Los Angeles, UCLA)组织配型中心提出了新的配型策略—HLA Res M,又称交叉反应组(cross reactive groups, CREG)配型,并于第11届国际临床组织相容性会议上一致通过,正式向UNOS申请。获得批准后成为继0 Ag MM后“第2个最佳配型标准”,对组织配型和器官移植产生了重大影响。随后,根据对Res M标准的研究和大宗临床肾脏移植患者回顾性随访分析结果,相继提出了几种模式的Res M标准。根据1996年第11届国际临床组织相容性会议上Terasaki的总结和1997年Takemoto、Terasaki的进一步完善,结合中国汉族人群5.6万份样本在美国UCLA组织配型中心的HLA分型结果计算机分析,目前比较认同的HLA Ⅰ类、Ⅱ类抗原氨基酸残基配型标准见表2、表3[42]。在同一Res M组的抗原,相容性较高。
(1)抗原表位:抗原表位可以被定义为结合特异性抗体所需的最小结构决定因素。抗体的抗原结合位点是由轻链和重链的可变(variable)区域的配对形成的。与抗原结合的抗体上的氨基酸的结构被称为抗体决定簇(paratope),对应的抗原结构被称为抗原表位(epitope)。抗原表位并不是蛋白质的固有属性,而是由它们与对应抗体相互作用的能力来确定。构成抗原表位的氨基酸残基可能在肽链中是连续的或者更常见的是由于肽链折叠的结果。抗体/抗原相互作用的X射线晶体学研究表明,抗原表位大约由10到22个氨基酸残基组成。因此,多数蛋白质包含多个上述氨基酸组成的结构,它们可能代表不同的、能够结合多种特异性抗体的抗原表位。
(2)抗原功能表位:Duquesnoy研究小组对抗原抗体复合物结晶结构的研究发现,抗原抗体结合特异性主要是由2~5个氨基酸组成的集群决定,称为抗原功能表位(eplet),功能表位位于一个大的结构表位(约15~20种氨基酸组成的)之中,所有这些氨基酸都参与抗原抗体结合。抗原功能表位必须在分子表面并至少包含1个多态性残基,以具有免疫原性。通过分析常见的HLA等位基因序列和三维蛋白质模型,Duquesnoy等确定了所有表面暴露的多态残基和与之相关的氨基酸簇的列表,这些序列可以定义一个潜在的功能抗原决定位。最初发现的序列只包括线性氨基酸序列,称为三元组,后来又补充了由于蛋白质折叠而产生的不连续序列。研究小组随后又整合了一组等位基因共享相同的蛋白质重叠集群,并推导出了所有潜在的抗原功能表位的列表,并把这些功能表位命名为eplet[43-44]。基于此,Duquesnoy团队创立了HLA Matchmaker软件(www.epitopes.net),通过分析供者所含有的非受者自身eplet个数的多少预测移植术后DSA产生的几率[45]。这一理论已被多篇临床研究所证实,且独立预测DSA发生几率的准确性明显优于HLA六位点错配数与HLA位点氨基酸残基错配数分析[46-48]。
(3)HLA Matchmaker:HLA Matchmaker是一种基于结构多态性的匹配程序。每个HLA抗原都被看作是一条包含多个抗体可及的由eplet构成的抗原表位链。HLA Matchmaker可以确定哪些eplet在供者和受者之间是不同的,用于临床确定HLA错配的可接受性。Eplet匹配原则: 如果一个供者的HLA抗原与受者的HLA抗原共享一个特定的eplet,那么这个eplet不会被认为是外来的eplet,也不会引起体液免疫反应。但是eplet匹配没有考虑抗体-抗原相互作用的其它结构基础,包括接触面积和结合能力等抗原性的本质。
DSA的产生除了与抗原抗体结合的epitope相关外,还涉及到B细胞的MHC Ⅱ类分子提呈供者HLA抗原给受者CD4+T细胞和辅助性T(helper T,Th)细胞,以此激活CD4+T细胞与Th细胞,并通过招募一系列效应细胞,最终协助产生抗体分泌型B细胞。基于此原理,PIRCHE公司创立了PIRCHE II分析法,预测受者HLA-DRB1分子提呈供者HLA相关肽链的能力。PIRCHE II分数越高,代表HLA-DRB1分子提呈供者HLA抗原能力越强。
德国柏林肾内科与肿瘤研究中心对于其中心1995年至2015年间的2787例肾脏移植受者进行回顾性分析,以明确HLA Matchmaker软件与PIRCHE II软件在预测DSA产生中的能力。研究人员利用HLA Matchmaker软件将供受者eplet的错配数进行分析,并利用PIRCHE II软件的PIRCHE II分数与新生DSA产生几率进行研究,结果显示:随着eplet错配数的增加,患者dnDSA产生几率也随之增加;随着PIRCHE II分数的增加,患者dnDSA发生率也随之增加。另外研究还发现,eplet错配数或PIRCHE II分数的增加与肾脏移植受者的移植肾存活率存在着明显的负相关关系;HLA-A、B、DR、DQ位点中,PIRCHE II分数低的受者的DSA产生几率明显低于PIRCHE II分数高的受者。进一步研究发现在HLA抗原错配不可避免时,通过PIRCHE II软件进行分析,选择PIRCHE II分数低的供者可以大大降低受者术后DSA的产生几率,且在HLA-DR、DQ位点错配时,意义更大[49-50]。
EMS-3D是一种新型计算评分系统,能够定量评估供受者HLA分子在三级结构水平上的表面静电电位差异;供者HLA的EMS-3D与DSA的产生密切相关,这种关系在HLA-DQ抗原中最强。EMS-3D基于通过x射线晶体学分辨的高质量的HLA结构信息,计算给定的HLA I类或II类分子的原子分辨率结构计算,使用同源建模,通过求解线性化的泊松玻耳兹曼方程(poisson boltzmann equation, PBE)数值,计算了HLA结构周围三维空间的静电势,将静电势比较转换为距离,从供受者HLA表面静电势的差异预测同种异体体液免疫反应[51]。
ASM评分是基于序列多态性的匹配体系。根据多肽氨基酸的数量和理化性质预测HLA同种异体抗原的免疫原性[52-53]。HLA分子的氨基酸序列分析能够在分子水平量化比较供受者的HLA差异,错配HLA的连续和非连续序列位置多态性氨基酸的差异数量能够预测其免疫原性、同种异体抗体反应强度和肾脏移植结局。
研究发现,免疫原性和非免疫原性HLA I类分子中的eplets数量和PIRCHE II数量具有正相关关系,并且他们在HLA I类分子中分布的区域相似[49]。HLA DR 及DQ位点eplets错配与ASM错配及EMS-3D错配呈显著正相关关系(R2>0.90),eplets错配、ASM错配和EMS预测无dnDSA生存时,HLA-DR分子每错配10个eplets或10分ASM或10分EMS-3D,则诱导dnDSA的风险分别增加2.5倍、1.49倍和1.23倍;HLA-DQ则分别增加1.98倍、1.24倍和1.14倍[54]。
目前国内常用的是HLA抗原位点匹配和氨基酸残基匹配,其余匹配方法由于需要HLA高分辨分型结果,尚未被广泛采用。无论采用哪一种方法,都是遵循少错配的原则。错配数越高,术后发生移植物排斥反应的风险越高。并且,用于确定供受者HLA错配的方法产生的结果之间具有相关性,因此,移植中心可根据本中心对HLA错配的方法的熟悉性和可操作性选择采用。
五、肾脏移植术前HLA抗体实验室检测
临床问题6:如何制定肾脏移植等待者术前HLA抗体检测方案?
推荐意见8:HLA抗体检测是肾脏移植术前评估等待者致敏广度和强度最直接,最有效的手段。推荐肾脏移植等待者登记前至少进行一次HLA抗体筛查检测,HLA抗体阳性等待者至少进行一次HLA抗体特异性检测(推荐强度B,证据等级2a)。
推荐意见9:建议HLA抗体筛查阴性者等待移植期间每6个月进行一次HLA抗体筛查检测;如果出现筛查阳性,或进行脱敏治疗等待者建议每3~6个月进行一次HLA抗体特异性检测(推荐强度D,证据等级5)。
HLA抗体纯化抗原检测方法采用纯化的HLA分子作为抗原载体,直接与受者血清反应,检测相应抗体,主要用于等待移植期间HLA抗体的检测。相较于细胞学检测法,纯化抗原法的优点是敏感度高,可操作性好;缺点是检测结果解读时,混杂因素较多,假阳性比例较高,受抗原组合的人群覆盖率影响,也存在一定的漏检可能性。纯化抗原检测法根据抗原的组合类型可分为以下三类:
HLA抗体筛检法是从潜在供者人群中,选取一组HLA抗原表达有代表性的人作为志愿者,获取组织细胞,体外扩增培养,并从细胞中纯化出HLA抗原,按照尽可能覆盖更多抗原类型的原则,形成检测用抗原组合,用于筛查受者血液样本中的HLA抗体。筛检法所用的抗原通常是从细胞表面纯化而得的HLA-I类和II类的混合抗原。
HLA-PRA检测法来源同上的纯化HLA抗原,按照尽可能模拟HLA抗原在潜在供者人群出现频率的原则,形成检测用抗原组合,最大程度模拟细胞学PRA法,检测受者样本中的针对HLA的PRA。
HLA抗体特异性检测采用HLA单抗原珠法(single antigen beads, SAB)。HLA-SAB检测法通过基因重组技术体外表达各种纯化的HLA抗原,每种抗原单独包被于一种固定相介质,比如微球、平板孔等(目前最常用的是单抗原微球),按尽可能覆盖人群常见抗原类型的原则,将包被不同抗原的介质形成一个组合,用于检测受者样本中针对不同HLA纯化抗原的抗体。
肾脏移植受者等待移植期间定期规律检测HLA抗体,对于评估致敏状态,预测术后排斥反应发生,指导免疫抑制方案具有重要的价值[55]。另外,由于等待者等待器官移植的时间不确定,建议HLA抗体筛查阴性者等待移植期间每6个月进行一次HLA抗体筛查检测;如果出现筛查阳性,或进行脱敏治疗等待者建议每3~6个月进行一次HLA抗体特异性检测,以便准确评估等待者免疫状态和针对不可接受抗原抗体的MFI值。
临床问题7:如何选择肾脏移植术前淋巴细胞毒交叉配型方法和评估致敏等待者免疫风险?
推荐意见10:肾脏移植术前进行淋巴细胞毒交叉配型是预防超急性排斥反应的重要手段。推荐肾脏移植术前进行补体依赖性细胞毒交叉配型方法,或流式细胞交叉配型方法,以提高其敏感性(推荐强度B,证据等级2a)。
推荐意见11:推荐致敏等待者根据补体依赖性细胞毒交叉配型方法,流式细胞交叉配型方法和HLA-SAB的结果,结合移植、妊娠、输血等致敏病史,综合评估肾脏移植免疫风险(推荐强度B,证据等级2a)。
常见的致敏因素包括再次移植、输血、妊娠、疫苗接种,病毒感染等病史。肾脏移植等待期间检测HLA抗体是评估等待者是否处于致敏状态最常见的实验室检测方法,包括HLA抗体的筛查(ELISA法或Luminex法)和HLA特异性抗体检测的HLA-SAB。肾脏移植手术前的抗体检测是评估受者体内是否存在pfDSA最直接的检测方法,包括补体依赖性细胞毒交叉反应(complement-dependent cytotoxicity cross mathch, CDC-XM)、流式细胞交叉反应(flow cytometry cross match, FC-XM)和虚拟交叉反应,对预防肾脏移植术后超急排斥反应具有非常重要的作用[55]。
HLA抗体细胞学检测法是使用来源于供者的、或代表潜在供者人群的细胞组合,作为抗原载体,与受者的血清(抗体)孵育,以产生的抗原抗体结合反应来检测受者血液样本中相应的抗体。细胞学检测法所检出的抗体包括HLA和非HLA同种异体抗体[56]。根据所用靶细胞的来源不同,细胞学检测法分为在供者细胞和受者血清之间进行的交叉反应法(cross-match, XM),以及在潜在供者人群细胞组合和受者血清之间进行的PRA。对于近期无妊娠、移植、输血等明确致敏史的HLA抗体阳性患者,细胞学抗体检测法(CDC-XM,FC-XM,CDC-PRA,或FC-PRA)可以确认对患者致敏状态判定的真实性。
XM检测法是用供者细胞作为靶细胞,检测受者体内是否存在DSA,是一种最直接而精准的、用于判定受者在接受供者移植物后是否会发生ABMR的方法。理论上,XM检测法是在供者组织细胞可获得情况下的最佳的、最直接的检测方法。
PRA检测法是在供者细胞不可获得的情况下,采用潜在供者人群中有足够代表性的部分个体的细胞组合作为抗原载体,来模拟整个潜在供者人群的抗原谱,检测受者体内是否存在相应抗体。根据阳性反应细胞在总靶细胞组合中所占的比例,来粗略预估受者体内预存的抗体对随机供者诱发ABMR的可能概率,是对可能导致排斥反应抗体的一种间接的检测方法。PRA检测法对潜在排斥反应的预测作用受到用于检测的细胞组合的人群代表性的影响,其敏感性和特异性远低于XM反应法[57]。
3.以细胞为基础的XM检测法和PRA检测法的结果判读(1)CDC-XM: 是把受者的血清和供者抗原载体细胞放在一起孵育,并添加补体。假如血清中存在针对载体细胞表面抗原的具有补体激活能力的抗体,抗原载体细胞就会被补体杀伤,对死亡细胞染色后,可对细胞培养板或通过流式细胞仪进行计数来判读结果[57-58]。CDC-XM实验检出的抗体是可以激活补体的抗体。根据淋巴细胞死亡百分比判断结果,并采取相应的临床决策(表4)。此方法要求淋巴细胞的活性在80%以上,灵敏度不高,对于低抗体滴度的HLA抗体容易出现假阴性。抗人免疫球蛋白(anti-human immunoglobulin, AHG)-CDC-XM对经典CDC-XM进行了改进,增强了补体激活,增加了XM的敏感性[59]。然而,这一方法的缺点是由于增加了AHG孵育步骤,可能增加淋巴细胞损伤的数量,从而产生更高的干扰背景,有可能出现无法解释的实验结果。
(2)FC-XM: 抗原载体细胞和受者血清孵育后清洗,通过细胞表面标志物荧光抗体(如:anti-IgG-FITC,anti-CD3-PerCP以及anti-CD19-PE)对结合和未结合受者血清抗体的供者T,B淋巴细胞进行标记,假如受者体内存在针对载体细胞表面抗原的抗体,结合到细胞表面的抗体就可以被荧光二抗标记[60]。FC-XM实验检出的抗体是所有能与靶细胞表面抗原发生结合反应的抗体,既包括能激活补体的抗体,也包括不能激活补体的抗体。结果的判读根据靶细胞表面是否有荧光二抗的结合及荧光强度决定,敏感性高于CDC-XM。检测样本平均荧光强度位移超过阴性对照30%,被判定为FC-XM阳性,T细胞FC-XM阳性,提示HLA-I类抗体阳性;B细胞FC-XM阳性,表示HLA-II和/或I 类抗体阳性[61]。FC-XM检测阳性不推荐行肾脏移植。
近年来随着HLA纯化抗原检测法的广泛推行,经典的细胞学检测法有被逐渐边缘化的趋势。然而,细胞学检测法的诸多优点,如细胞表面抗原的天然完整性、细胞表面包含的同种异体的多样性(HLA类和非HLA类同种异体抗原)等特点,决定了其具备纯化抗原检测法所不可替代的独特优势。早在1960年代末,Paul Terasaki教授就报道了CDC-XM对移植后发生ABMR的预测作用,而且其预测作用明显高于CDC-PRA检测法[62]。
在供者细胞可获取的情况下,移植前细胞学XM检测法是预测潜在ABMR的首选方法。由于HLA抗体细胞学检测方法,尤其是交叉配型方法受技术人员操作经验、试剂质量等因素影响大,敏感性低导致检测结果阴性等情况的存在。另外,等待移植患者可能通过妊娠或输血暴露于同种HLA抗原,并对其产生应答,致敏等待者体内存在记忆性淋巴细胞,但完全有可能在当前的血清中检测不到HLA抗体[63]。因此对肾脏移植术前受者需要根据CDC-XM、FC-XM和HLA- SAB的结果,结合移植、妊娠、输血等致敏病史,综合评估肾脏移植免疫风险。
推荐意见12:HLA抗体MFI值可能受到检测微球饱和度的影响,只能在一定范围内代表抗体的强度,不能完全代表抗体的滴度。对存在HLA抗体MFI>10 000的致敏患者,接受脱敏治疗时,建议通过梯度稀释的方法,检测HLA抗体滴度至线性范围,作为判断治疗效果的参考依据(推荐强度B,证据等级2b)。
HLA抗体,特别是DSA,在肾脏移植相关的诊断和决策中起着关键作用。单纯区分HLA DSA是否存在并不能在所有临床情况下提供足够的信息。此外,HLA抗体强度在肾脏移植过程的不同受者评估阶段具有潜在的作用,从最初的移植前评估,特定潜在供者的评估,以及移植后对dnDSA的监测。
HLA抗体MFI值在一定范围内可以代表抗体的强度,但是不能完全代表抗体的强度。高MFI值通常被称为高滴度抗体,但是如果通过稀释血清进行实际测试,一些MFI值相对较高的抗体可能稀释得相当快,因此不符合高效价抗体的条件。在存在补体抑制、表位扩散或检测微珠饱和的情况下,抗体强度与MFI之间的相关性明显受到影响。如果抗体MFI为10 000,应进行至少1次稀释,以确定抗体强度是否受到微球饱和度的影响。如果患者基线HLA MFI为10 000,检测样本如出现MFI>10 000的抗体,建议使用一些稀释剂,直到抗体水平降至10 000左右,以便比较不同临床试验的结果,并确定最有效的方法来匹配不同的临床情况。
在等待移植期间的评估中,许多患者不需要精确的抗体滴定,因为有问题的抗体被认为是不可接受的。另外,如果考虑脱敏(例如,高度敏感的患者有潜在的活体供者),稀释血清是检测抗体真实强度的唯一方法,为有效将抗体降低到可接受水平的可能性提供指导。此外,稀释血清还可以监测脱敏的效果或对ABMR的治疗反应[63]。
临床问题9:肾脏移植术前等待者HLA抗体的MFI值大于多少需要HLA匹配时避开?
推荐意见13:等待者不可接受错配HLA抗体的MFI阈值,取决于HLA位点及抗原特异性。通常针对HLA-A,B,DR,DQ pfDSA MFI>2000时, HLA匹配时需要避开;各器官移植中心也可以根据临床工作经验,适当放宽不可接受错配HLA抗体的MFI阈值(推荐强度B,证据等级2b)。
目前对于HLA抗体的检测结果,没有统一的阳性阈值标准。HLA抗体的MFI值范围从500到超过10 000不等,取决于HLA分子类别,位点及抗原特异性。许多存在抗原共享表位的HLA抗体,可能会在SAB检测时产生较低的MFI值,因此单个抗原的MFI不足以代表该基因型抗原的抗体总量。除此之外,MFI阈值还受到实验平台的测试方案、技术人员的经验和各移植中心临床实践中不同的接受标准等因素的影响[64]。HLA抗体MFI阈值在大多数情况下由移植中心自行决定。
虽然SAB检测的HLA抗体MFI是半定量,但初始MFI具有一定的预警价值。目前文献报道最多的MFI阈值标准为1000 或2000,MFI值越高发生ABMR的风险越高,尤其是在大于3000以上时,相对风险增高了65.3倍,大于6000时相对风险增高了156.8倍[65]。需要指出的是,当SAB检测到受者的pfDSA所针对的HLA(例如上一次移植物的HLA)与本次潜在供者错配HLA有重复时,即使其MFI值较低,也明确提示受者对该HLA位点存在免疫记忆,发生强烈免疫记忆反应风险很大,应尽量避免,或采取足够的预防措施。
根据国内外多家HLA配型室的经验,HLA-A,B,DR抗体的MFI值小于2000,DQ抗体的MFI值小于5000,DP抗体的MFI值小于7000,C抗体的MFI值小于10 000时,通常不会导致FC-XM阳性。在基于MFI值的虚拟配型成功后,还需通过移植前获得的潜在捐献者细胞进行交叉反应,来最终确定是否能够移植。建议用流式细胞法阴性作为最终可行移植的标准。同时建议国内各移植中心配型室积极摸索MFI值与常规CDC-XM、FC-XM的对应关系,以建立符合实验室检测条件的既安全又合理的判读不可接受错配抗原的MFI值水平。以下表5为单抗体MFI值与交叉配型结果的实验室检测经验,供参考。
表5 单抗体MFI值与交叉配型结果的实验室检测经验(仅提供参考)
注:MCS:Median Channel Shift
临床问题10:如何进行虚拟交叉配型,在什么情况下进行虚拟交叉配型?
推荐意见14:虚拟交叉配型根据供者HLA高分辨分型结果和受者当前或既往的HLA特异性抗体检测结果进行对比分析,评估供受者HLA相容性。虚拟交叉配型增强了致敏受者识别pfDSA的能力,减少了不必要的实际交叉配型,增加了高致敏患者找到交叉配型兼容供者的可能性。致敏等待者在获得潜在捐献者HLA高分辨分型结果后,即可进行虚拟交叉配型(推荐强度B,证据等级2b)。
虚拟交叉配型(virtual crossmatch, VXM)不需要检测存活的供者细胞与受者血清的真实反应,而是基于供者HLA高分辨分型和受者当前或既往的HLA特异性抗体SAB检测结果,分析评估供受者免疫相容性。由于SAB方法增强了HLA抗体检测能力,VXM的概念逐渐被接受,用以判断拟接受器官移植受者体内是否存在pfDSA或特异性记忆性淋巴细胞。与CDC-XM相比,VXM考虑了特定接受者针对特定供者所具有的当前和所有历史抗体,而实际交叉配型仅对受者移植前一个时间点的抗体进行检测。因此,VXM是一种基于患者同种抗体谱的更全面的免疫相容性评估。由于VXM增强了识别pfDSA的能力,减少了不必要的实际交叉配型,提高了致敏患者找到兼容供者的可能性,因此在许多情况下VXM比CDC-XM或FC-XM具有更显著的优势[66]。
临床问题11:HLA抗体检测方法存在哪些不足,如何改进?
推荐意见15:HLA抗体传统CDC-XM检测的阳性检出率偏低,建议标准化实验室检测技术,或采用更加敏感的方法,如FC-XM技术,或改良的抗人免疫球蛋白-CDC-XM技术(推荐强度B,证据等级2b)。
推荐意见16:HLA抗体纯化抗原检测法可能存在漏检和假阳性的情况,但极少出现。临床上在对HLA抗体阳性检测结果存疑时,可采用细胞学检测法加以验证(推荐强度D,证据等级5)。
(1)CDC-XM阳性检出率低有两种可能:①移植前病人预致敏的抗原恰巧是供者抗原或与供者抗原有交叉反应的抗原的概率本身就低,加上预致敏导致的抗体不一定都是补体依赖的有细胞毒作用的抗体,因而通过补体依赖性细胞毒作用检测技术不一定能检测到所有预致敏抗体;②CDC检测技术中所用的关键试剂-补体经过长期保存或者多次冻融,非常容易失活,导致假阴性反应。
(2)针对以上情况解决的办法有以下三种:①可以考虑完善CDC-XM技术,比如实验设计中要有可靠的阳性对照组以确保补体有效;②可选用AHG-CDC-XM以提高阳性检出的敏感性;③可用FC-XM的方法替代CDC-XM,提高阳性检出率,因为FC-XM检测法可以检出所有和供者抗原结合的抗体,不仅对有补体依赖性细胞毒作用的抗体引起的ABMR有预测作用,而且对抗体依赖的细胞介导的细胞毒性作用(antibody-dependent cell-mediated cytotoxicity, ADCC)引起的ABMR也会有较好的预测作用[59-62]。
作为最早被发现的和移植排斥相关的人群多态性抗原,HLA引起的体液免疫反应,即HLA抗体导致的ABMR在最近20年得到了广泛而深入的研究[67-68]。由于纯化HLA检测法较之细胞学检测法而言,具有不需要活细胞、操作简单、可重复性好等优点,近年来在临床上得到了广泛的应用,大有取代细胞学检测法的趋势。但是由于HLA数量巨大、纯化抗原的完整性不易保持等客观原因,纯化HLA检测法也有其致命的缺点—漏检和假阳性的问题。
(1)纯化HLA抗原检测法的漏检问题:纯化抗原(HLA)检测法只能检出HLA特异性抗体,和细胞学检测法比较,漏检所有非HLA类同种异体抗原的特异性抗体。纯化抗原检测法会因为靶标抗原或抗原的组合选取不够具有代表性,或选取数量不足,导致漏检HLA抗体,尤其是DSA。由于HLA是目前为止最具多态性的一类抗原,其数量达到数万种,而目前商品化的检测试剂所包括的HLA-I类或II类抗原一般在百种以下,加之HLA的类型存在种群差异,因此使得HLA纯化抗原检测法在不同种群中使用都会出现漏检现象,假如试剂盒最初设计使用时有预设的靶向人群,在其他特定人群中使用时就会出现较为严重的漏检现象。
(2)纯化HLA抗原检测法的假阳性问题:纯化抗原法检测HLA抗体时,常常会出现假阳性反应的问题,原因主要包括,抗原在纯化、包被过程中发生结构变性,或者是纯化的抗原是在非人源细胞表达系统表达纯化而来。HLA抗体筛检法和HLA-PRA检测法所使用的抗原通常是来自于人源细胞的天然抗原,而HLA抗体特异性检测所使用的抗原是通过基因重组表达的抗原,抗原蛋白表达系统可以是哺乳动物(包括人源细胞)、昆虫、酵母、细菌、藻类和无细胞系统,不同系统表达的蛋白在三维构象和表达后的修饰会有很大的不同,因此,HLA抗体特异性检测所用的抗原是一种人工合成的蛋白抗原,在模拟细胞表面天然HLA的结构方面,会因为表达系统的变化而有很大的不同。之前的研究曾发现,流式点阵仪微球法(如Luminex)检测的HLA抗体中包含变性HLA特异性的抗体,而这些抗体和排斥反应并没有显著相关关系[69]。
虽然HLA抗体纯化抗原检测法可能存在漏检和假阳性的情况,但这些情况在临床工作中极少出现。临床上如对HLA抗体阳性检测结果存疑时,可采用特异性HLA抗原的细胞学检测法加以验证。
推荐意见17:HLA抗体检测质量控制包括:制定申请单,样本接收及前处理等SOP;制定试剂、关键耗材、仪器维护和校准、室内质量控制规则、数据分析、结果复核等质量控制管理程序文件;实验室可通过参加室间质评或比对方法验证检测能力;要求结果报告内容清晰规范,临床解读科学严谨(推荐强度D,证据等级5)。
HLA抗体检测技术受检测方法、试剂种类繁多等因素影响,在实验操作方法、试剂的质量确认和结果分析等方面,还存在很多亟需规范的问题。HLA抗体检测质量控制包括检测前、中、后的实验过程,以及结果报告和临床解读的质量控制[30,70-73]。
(1)申请单:需要由临床或协议单位共同参与申请单内容制定及评估。
(2)样本接收:实验室需针对接受样本的来源、类型等,建立不同样本接收、拒收程序文件及前处理的SOP文件。
(3)制定样本处理SOP:对检测结果存在质疑的样本进行预处理,如吸附、血清稀释、EDTA处理等。
(1)试剂和耗材的管理:实验室应建立试剂、关键耗材的质量管理程序文件,包括试剂订购、接收、保存、质控、使用期(包括分装后使用期)、有效期等过程。
(2)仪器维护和校准:对于流式荧光检测仪进行日维护、月维护、年维护、校准等工作,以及仪器搬迁后应进行仪器校准及性能验证。
(3)室内质量控制:建立室内质控物的类型、检测频次、质控物的位置、质控记录、在控和失控规则的质量管理程序性文件。阳性质控物宜采用临床样本、标准品、细胞株等。阴性质控物为商品化标准阴性质控血清;阳性质控物无商品化产品及标准品等,实验室可自行制备。
(4)能力验证或室间质评:根据开展临床检测项目制定能力验证计划,包括参加机构、频次、样本数量、判断标准等,均符合实验室开展项目的临床预期用途。采用比对方案时,应选择获得中国合格评定国家认可委员会(China National Accreditation Commission for Conformity Assessment, CNAS)的认可和相关国际认证实验室或使用相同检测方法的同级别或高级别实验室,确定比对方式的可接受性、规定比对样本数量、频次、判断标准等,并形成比对报告。
(5)数据分析的质量控制:仪器产出的原始数据导入试剂配套分析软件被有效识别,分析参数至少达到试剂厂家说明书的最低要求时,判断为质量合格,并进一步分析。在分析过程中重点关注微珠荧光信号值等关键指标。应保留结果分析过程中的所有记录,对于数据质量不合格的样本,分析原因并采取纠正措施。
(1)结果复核的质量控制:实验室对结果复核应包括但不限于以下内容:对申请单上基本信息、检测项目、样本编号,以及影响样本质量和检测结果判断的诊疗信息的复核;对实验操作关键步骤、数据分析关键指标的复核;对报告单上的结果,结果解释、备注及建议等的复核。所有复核过程均应保留记录。
(2)检验后样本的保存和使用:实验室检验后样本的保存与处理方式应按照CNAS认可等要求执行,通过评估后规定检验后样本储存有效性的条件和期限。
(1)结果报告的质量控制:实验室应在HLA抗体报告单中包括但不限于以下内容:患者诊断、致敏史、抗体相关治疗方式及治疗时间、样本接收和检测时间、试剂和仪器、初筛抗体阴阳性、上报的抗体类型、临床意义及进一步检测的建议、让步检验说明等,并且应规范、正确使用带有认可或认证资质标识的报告单。
(2)HLA抗体报告的临床解读:实验室应根据临床需要对HLA抗体报告单进行相关解读,包括但不限于以下内容:预存高MFI值HLA抗体、预存DSA分析、HLA抗体治疗情况MFI值分析、判断移植后的抗体为新生抗体或预存抗体分析、新生DSA及交叉反应组抗体分析等。
临床问题13:肾脏移植等待者是否需要使用cPRA评估致敏程度?
推荐意见18:cPRA是根据等待者的HLA特异性抗体检测结果,结合可代表潜在捐献人群的HLA基因位点的分布频率,通过科学方法计算获得。cPRA的数值表示致敏等待者接受未来所有捐献者的器官时不能避开其PRA阳性位点的概率,比实际PRA结果更能准确的反映等待者的致敏广度和获得捐献肾脏的机会。为了更加科学统一地评估器官移植等待者的致敏程度,保证高致敏等待者获得肾脏优先分配的公正性,推荐使用cPRA评估我国肾脏移植等待者的致敏程度(推荐强度B,证据等级2b)。
致敏因素可导致等待者体内产生不同广度、不同强度的抗HLA抗体。在COTRS中,致敏等待者是指器官衰竭患者,体内预存有HLA抗体的人群。目前普遍认可的标准是PRA超过20%为致敏,达到80%以上为高致敏。2009年UNOS开始采用cPRA来评估受者的致敏程度。不区分致敏程度的肾脏移植,一方面造成低致敏受者等待时间延长,另一方面高致敏受者接受肾脏移植具有较高的超急性或急性抗体介导排斥反应的风险,导致术后移植物存活率及存活时间较未致敏患者明显下降。
PRA是指器官移植受者血清中针对代表供者人群的一组细胞或纯化HLA的特异性抗体。PRA主要是在器官移植、输血、妊娠等情况下由同种异体HLA抗原免疫或微生物感染后交叉免疫反应而产生,在一定程度上反映了等待者的致敏强度和广度,在HLA致敏等待者的免疫评估中具有一定的指导作用。为了更准确统一的量化评估器官移植等待者的致敏程度,并切实保证高致敏等待者的肾脏优先分配的公正性,2009年UNOS正式以 cPRA取代PRA,作为分配系统的参考依据[74]。cPRA是依据人群HLA频率,计算供者HLA不能被致敏受者所接受的百分比。PRA和cPRA两者数值越高均表示等待者获得HLA相容的供肾机会越小。PRA是患者血清与代表供者人群HLA抗原的免疫反应结果,分别检测HLA-I类抗体阳性率和HLA-II类抗体阳性率。cPRA则是根据等待者不可接受抗原(unacceptable antigen, UA)和真实世界的潜在供者HLA频率计算所得,将HLA I类和II类抗体的阳性位点整合计算。分配系统对携带有致敏等待者UA的供器官,将自动不分配给致敏受者。因此,致敏程度越高,UA越多,致敏者接受供肾的机会越少。
推荐意见19:cPRA计算包括确定肾脏移植受者UA、确定参考人群的HLA等位基因频率及算法等步骤。推荐各移植中心参考HLA等位基因包括HLA-A、B、C、DRB1、DR345、DQB1和DQA1,上报致敏等待者UA高分辨基因型;推荐参考《中国常见及确认的 HLA 等位基因表(CWD) 确定参考人群的HLA基因频率;推荐采用供者过滤法计算我国肾脏移植等待者的cPRA (推荐强度B,证据等级2b)。
cPRA的计算的基本原理是:依据受者HLA-SAB法得到的HLA抗体检测结果,由移植医师和HLA专家讨论确定致敏受者UA,上传器官分配系统,系统根据潜在供者人群HLA频率,计算不能被致敏受者接受的供者百分比。cPRA计算包括确定UA位点、确定参考人群的HLA等位基因频率及算法等关键步骤,不同国家或地区采用的标准或方法有所不同[74-80]。随着对肾脏移植患者抗HLA抗体的特性和作用的深入认识,相关技术标准也会更新迭代。
PRA阳性的肾脏移植等待者通过SAB检测,明确HLA抗体所针对的HLA基因型及其MFI,肾脏移植医师和HLA专家讨论设置MFI阈值或标准,以确定致敏等待者UA。可通过HLA血清型和基因型确定致敏受者UA。我国COTRS当前要求填报血清型UA,如需获得准确cPRA,需要将填报的UA升级到高分辨基因水平。
关于UA参考的HLA基因座,UNOS早期阶段只纳入HLA-A,B,DR,随着对HLA基因座在ABMR中作用的不断认知,目前扩充至HLA-A,B,Bw,C,DR(含DR345)和DQB1。欧洲移植联盟采用相近的标准。加拿大的参考位点还包括HLA-Cw,DPA,DPB和DQA[75]。根据我国死亡后捐献供者(deceased donor, DD)HLA检测现状及COTRS预设的UA填报要求,建议参考HLA基因座包括HLA-A,B,C,DR(含DR345),DQB1和DQA1。
美国、欧洲移植联盟(包括澳大利亚和新西兰)、加拿大等国家均采用死亡供者的真实大样本HLA基因数据库代表潜在供者人群,作为自己国家或地区的cPRA计算工具的依据。我国尚没有代表性的死亡供者HLA基因频率表,由于种族差异大而不能直接使用欧美数据。研究表明,采用国家骨髓库供者HLA可计算获得相近的cPRA结果[81]。据此,我国可参考《中国常见及确认的 HLA 等位基因表(CWD)2.4 版本》(中国造血干细胞捐献者资料库管理中心 CWD 表编撰组)计算肾脏移植等待者cPRA。
确定致敏等待者UA和参考HLA基因频率后,可通过两种算法计算cPRA。供者过滤法和等位基因频率法[78]。
(1)供者过滤法:是指在计算机程序内,等待者的每个UA与潜在供者的HLA基因型逐一比较,过滤含有UA的供者;cPRA值即过滤掉的供者人数占样本库总人数的百分比,代表致敏等待者遇到HLA不相容供肾的可能性。欧洲移植联盟采用此法计算cRPA。
(2)等位基因频率法:是指根据既定供者参考人群的HLA基因型数据库,通过计算机程序(如Arlequin 3.5)推算出参考人群的HLA单倍型频率,进一步计算该人群携带UA的概率,基本原理公式为cPRA= 1- (1-Σpi)2 (Σpi为含有UA的所有单倍型累积频率)。美国、加拿大和西班牙等国家采用此法计算cPRA。考虑到我国参考人群基因型的统计现状和计算便利,建议采用供者过滤法计算我国肾脏移植等待者的cPRA。
临床问题15:满足何种条件的致敏等待者可以享有供肾分配优先权?
推荐意见20:致敏患者的PRA或cPRA值越高,接收HLA相容供肾的机会越低,在供肾分配上应给予公平性优先。建议给予cPRA≥98%或PRA≥80%的致敏等待者在各级范围的轮转分配中给予优先权,使此类患者有更大的几率移植(推荐强度B,证据等级2b);
推荐意见21:对于21%≤cPRA<98%或21%≤PRA<80%的等待者在OPO服务区内的供肾分配享有不同程度的优先权(推荐强度B,证据等级2b)。
cPRA值越高,接收HLA相容供肾的机会越低,在供肾分配上应给予公平性优先。OPTN既往仅为cPRA≥80%的等待者额外增加4分,新实施的分配政策则有更多规定增加高致敏等待者的移植机会[74]。cPRA≥20%获额外加分,cPRA值越接近100%,越能获得显著增高的分数(例如:cPRA 80%~84%加2.46分,cPRA=95%加10.82分,cPRA=98%加24.40分,cPRA=99%加50.09分,cPRA=100%加202.10分);cPRA≥99%的高致敏等待者在全国范围内分配享有优先权,仅次于HLA-A,B,DR零错配;cPRA≥98%的高致敏等待者在OPO服务区内分配仅次于HLA-A,B,DR零错配;cPRA≥80%在OPO服务区内、区域以及全国范围内分配仅次于HLA-A,B,DR零错配,估算移植后存活评分(estimate post-transplant survival score, EPTS)≤20%和儿童等待者;21%≤cPRA≤79%等待者在各级范围的轮转分配中也享有不同程度的优先权。
目前我国器官移植分配政策依据《人体器官捐献与移植条例》规定的原则和标准建立,在供受者HLA匹配优先原则方面,主要体现在两个方面:给予PRA≥80%的高致敏等待者一定的优先权;给予HLA零错配或匹配度较高的等待者一定的优先权。随着我国器官捐献与移植事业的发展,再次移植和致敏等待者越来越多,我国现阶段亟需推荐一个有利于致敏等待者获得公平移植的原则。建议根据国际已有的实践经验,以cPRA替代PRA,对不同区间cPRA的致敏等待者实行不同的加分标准,增加所有致敏等待者获得移植的公平机会。
组织配型是影响肾脏移植成功的关键因素之一。本指南基于我国目前肾脏移植发展的主要目标,提升移植肾术后长期存活,针对临床组织配型的常见问题进行推荐和说明。主要包括供受者HLA分型技术,HLA匹配,HLA抗体检测相关技术,cPRA等内容。
目前,肾脏受者的免疫风险评估主要基于HLA系统[82]。关于非HLA免疫和遗传方面的深入研究正在不断发展。从临床角度来看,将非HLA抗体纳入免疫风险评估有利于排斥反应的预测和防治,并且有助于综合理解移植肾损伤中的同种异体免疫和自身免疫。移植术后非HLA抗体检测和使用全基因组技术来评估供受者非HLA错配,对于支持未来移植免疫的研究方向和非HLA免疫领域的靶向治疗方法研发具有重要的意义[83-90]。由于非HLA抗体检测和非HLA基因变异多态性检测缺少公认的标准检测方法和试剂,本指南未进行推荐和说明。
本指南部分临床问题目前还缺乏有力的循证医学证据,同时临床实践中也存在一些有待回答的问题,如:HLA错配表位的免疫原性如何评估?HLA错配评估的不同方法是否可以联合评估B细胞和T细胞的同种异体反应性? 术前非HLA抗体对术后移植物的作用分类(排斥反应相关、肾病相关、移植物损伤相关)?如何提高肾脏移植术前供者特异性记忆T、B细胞定量测定的准确性和高效性?等问题[88]。这些内容有可能改善肾脏移植患者的预后和长期存活,为推动肾脏移植供受者选择达到更精准的层面,促进器官分配的科学发展,及肾脏移植受者个体化精准免疫抑制治疗奠定基础。
执笔作者:郑瑾(西安交通大学第一附属医院),张雷(海军军医大学附属长海医院器官移植科),何军(苏州大学附属第一医院),蔡俊超(苏州才博医学研究所),刘龙山(中山大学附属第一医院)
通信作者:薛武军(西安交通大学第一附属医院),
Email:xwujun126@xjtu.edu.cn
主审专家:薛武军(西安交通大学第一附属医院),陈刚(华中科技大学同济医学院附属同济医院),朱同玉(复旦大学附属中山医院)
审稿专家:朱有华(海军军医大学附属长海医院),王长希(中山大学附属第一医院),吴建永(浙江大学医学院附属第一医院),田普训(西安交通大学第一附属医院),戎瑞明(复旦大学附属中山医院),王祥慧(上海市交通大学医学院附属瑞金医院),付迎新(深圳市第三人民医院),张明(上海交通大学医学院附属仁济医院),林涛(四川大学华西医院),程颖(中国医科大学附属第一医院),林俊(首都医科大学附属北京友谊医院),陈劲松(东部战区总医院),尚文俊(郑州大学第一附属医院),肖漓(中国人民解放军总医院),叶欣(广州血液中心),邹义洲(中南大学基础医学院),黄玉华(苏州大学附属第一医院),齐珺(陕西省血液中心),郑仲征(深圳市丝路启航免疫与代谢研究院),崔瑜(浙江大学医学院附属第一医院),赵亚玲(西安交通大学医学部公共卫生学院流行病与卫生统计学系)
利益冲突:所有作者声明无利益冲突。
参考文献
[1] HART A, SMITH J M, SKEANS M A, et al. OPTN/SRTR 2016 Annual Data Report: Kidney. Am J Transplant, 2018, 1(Suppl 1): 18–113.
[2] SELLARÉS J, DE FREITAS DG, MENGEL M, et al. Understanding the causes of kidney transplant failure: The dominant role of antibody-mediated rejection and nonadherence. Am J Transplant, 2012, 12(2): 388–399.
[3] TERASAKI PI, CAI J. Humoral theory of transplantation. Am J Transplant,2005,17(5): 665–673.
[4] 陈实. 移植学. 北京: 人民卫生出版社, 2011: 79-86.
[5] HALLORAN PF, REEVE JP, PEREIRA AB, et al. Antibody-mediated rejection, T cell-mediated rejection, and the injury-repair response: new insights from the Genome Canada studies of kidney transplant biopsies. Kidney international, 2014, 85 (2): 258-264.
[6] ALI AA, ALMUKHTAR SE, ABD KH, et al. The causes and frequency of kidney allograft failure in a low-resource setting: observational data from Iraqi Kurdistan. BMC Nephrol, 2021, 22(1): 272.
[7] CECKA JM. The UNOS renal transplant registry. Clin Transpl. 2001:1-18.
[8] TAKIFF H, COOK DJ, HIMAYA NS, et al. Dominant effect of histocompatibility on ten-year kidney transplant survival. Transplantation, 1988, 45 (2): 410-415.
[9] 谭建明, 唐孝达. HLA-DR 基因相容对肾移植长期存活的影响. 中华器官移植杂志, 2000, (21): 109-111.
[10] MICKEY MR. HLA matching in transplants from cadaver donors. Clinical Kidney Transplants. 1985. 45–56.
[11] TING A, MORRIS PJ. Matching for the B-cell antigens of the HLA-DR series in cadaver renal transplantation. Lancet, 1978, 1: 575.
[12] CECKA JM. The UNOS scientific renal transplant registry—ten years of kidney transplants. Clinical Transplants, 1998. 1–16.
[13] TAMBUR AR, CAMPBELL P, CHONG AS, et al. Sensitization in Transplantation: Assessment of Risk (STAR) 2019 Working Group Meeting Report. Am J Transplant, 2020, 20(10): 2652-2668.
[14] SAPIR-PICHHADZE R, ZHANG X, FERRADJI A, et al. Epitopes as characterized by antibody-verified eplet mismatches determine risk of kidney transplant loss. Kidney Int, 2020, 97(4): 778-785.
[15] 张雷. 赢在起点:人类白细胞抗原分子配型在器官移植临床的探索应用. 中华器官移植杂志, 2020, 41(12): 707-708.
[16] 薛武军, 郑瑾. 重视组织配型和供者特异性抗体监测在肾移植中的重要作用. 器官移植, 2014, 5(2):63-65.
[17] KEITH DS, VRANIC GM. Approach to the highly sensitized kidney transplant candidate. Clin J Am Soc Nephrol, 2016, 11(4): 684-693.
[18] SÜSAL C, MORATH C. Virtual PRA replaces traditional PRA: small change but significantly more justice for sensitized patients. Transpl Int, 2015, 28(6): 708-709.
[19] HUBER L, LACHMANN N, NIEMANN M, et al. Pretransplant virtual PRA and long-term outcomes of kidney transplant recipients. Transpl Int, 2015, 28(6): 710-719.
[20] MALHEIRO J, TAFULO S, DIAS L, et al. Analysis of preformed donor-specific anti-HLA antibodies characteristics for prediction of antibody-mediated rejection in kidney transplantation. Transpl Immunol, 2015, 32(2): 66-71.
[21] WILPERT J, FISCHER KG, PISARSKI P, et al. Long-term outcome of ABO-incompatible living donor kidney transplantation based on antigen-specific desensitization. An observational comparative analysis. Nephrol Dial Transpl, 2010, 25(11): 3778–3786.
[22] SHIN E, KWON SW, YANG WS, et al. Long-term outcomes of ABO-incompatible living donor kidney transplantation: a comparative analysis. Transpl Proc, 2015, 47(6): 1720–1726.
[23] MORRIS AB, SULLIVAN HC, KRUMMEY SM, et al. Out with the old, in with the new: Virtual versus physical crossmatching in the modern era. HLA, 2019, 94 (6): 471-481.
[24] LAN JH, KADATZ M, CHANG DT, et al. Pretransplant Calculated Panel Reactive Antibody in the Absence of Donor-Specific Antibody and Kidney Allograft Survival. Clin J Am Soc Nephrol, 2021, 16(2): 275-283.
[25] CHOI J, CHANDRAKER A. Immunologic risk assessment and approach to immunosuppression regimen in kidney transplantation. Clin Lab Med, 2019, 39(4): 643-656.
[26] 朱有华, 曾力. 肾移植. 北京: 人民卫生出版社, 2017: 72-85.
[27] BUNCE M, PASSEY B. HLA typing by sequence-specific primers. Methods Mol Biol, 2013, 1034: 147-159.
[28] DALVA K, BEKSAC M. HLA Typing with Sequence-Specific Oligonucleotide Primed PCR (PCR-SSO) and Use of the Luminex™ Technology. Methods in Molecular Medicine, 2007, 134: 61–69.
[29] VOORTER CE, PALUSCI F, TILANUS MG. Sequence-based typing of HLA: an improved group-specific full-length gene sequencing approach. Methods Mol Biol, 2014, 1109: 101-14.
[30] PROFAIZER T, KUMÁNOVICS A. Human Leukocyte Antigen Typing by Next-Generation Sequencing. Clin Lab Med, 2018, 38(4): 565-578.
[31] 陈璐瑶, 李杨, 张腾腾等. HLA-A,-B,-C,-DRB1,-DQB1单倍型频率的临床意义. 中华血液学杂志, 2019, 040(012): 1026-1030.
[32] 魏雪栋, 何军, 袁晓妮等. 肾移植术后抗人类白细胞抗原抗体的变化特征及临床研究. 中华实验外科杂志, 2017, 34(012): 2071-2074.
[33] Standards for Accredited Laboratories. American Society for Histocompatibility and Immunogenetics. Final Revised Standards Approved by the ASHI Board of Directors: February 16, 2021. Guidance Final Version November, 2020.
[34] 何军. 人类白细胞抗原基因分型技术平台规范化建设及临床应用专家共识. 中华医学杂志. 2023, 103(31): 2389-2411.
[35] 曹雪涛. 医学免疫学. 北京: 人民卫生出版社, 2018: 68-74.
[36] HORTON R, WILMING L, RAND V, et al. Gene map of the extended human MHC. Nat Rev Genet, 2004, 5: 889-899.
[37] http://www.ebi.ac.uk/ipd/imgt/hla/alleles/.
[38] TING A, MORRIS PJ. Matching for the B-cell antigens of the HLA-DR series in cadaver renal transplantation. Lancet, 1978, 1(8064): 575-577.
[39] TING A, MORRIS PJ. Powerful effect of HLA-DR matching on survival of cadaveric renal allografts. Lancet, 1980, 2(8189): 282-285.
[40] CECKA JM. The UNOS scientific renal transplant registry—ten years of kidney transplants. Clinical Transplants, 1997: 1–14.
[41] TAMBUR AR, CAMPBELL P, CHONG AS, et al. Sensitization in transplantation: Assessment of risk (STAR) 2019 Working Group Meeting Report. American journal of transplantation, 2020, 20(10): 2652-2668.
[42] 肖漓, 郑瑾, 肖露露. 肾移植组织配型及免疫监测技术操作规范(2019). 中华医学会器官移植学分会,器官移植. 2019, 10(5): 513-520.
[43] DUQUESNOY RJ. HLA matchmaker: a molecularly based algorithm for histocompatibility determination I Description of the algorithm. Hum Immunol, 2002, 63(5): 339-352.
[44] STAVE JW, LINDPAINTNER K. Antibody and Antigen Contact Residues Define Epitope and Paratope Size and Structure. J Immunol, 2013, 191(3): 1428-1435.
[45] DUQUESNOY RJ. A structurally based approach to determine HLA compatibility at the humoral immune level. Hum Immunol, 2006, 67(11): 847-862.
[46] SENEV A, COEMANS M, LERUT E, et al. Eplet Mismatch Load and De Novo Occurrence of Donor-Specific Anti-HLA Antibodies, Rejection, and Graft Failure after Kidney Transplantation: An Observational Cohort Study. Journal of the American Society of Nephrology, 2020, 31(9): 2193-2204.
[47] PHILOGENE MC, AMIN A, ZHOU S, et al. Eplet mismatch analysis and allograft outcome across racially diverse groups in a pediatric transplant cohort: a single-center analysis. Pediatric nephrology, 2020, 35 (1): 83-94.
[48] TAFULO S, MALHEIRO J, SANTOS S, et al. Degree of HLA class II eplet mismatch load improves prediction of antibody-mediated rejection in living donor kidney transplantation. Human immunology, 2019, 80 (12): 966-975.
[49] OTTEN HG, CALIS JJ, KEŞMIR C, et al. Predicted indirectly recognizable HLA epitopes presented by HLA-DR correlate with the de novo development of donor-specific HLA IgG antibodies after kidney transplantation. Hum Immunol, 2013, 74(3): 290-296.
[50] 郑瑾, 匡陪丹, 张颖等. 人类白细胞抗原抗体频率及PIRCHE评分与DSA产生及AMR发生的关系. 中华医学杂志, 2019, 99(12): 901-906.
[51] MALLON DH, KLING C, ROBB M, et al. Predicting Humoral Alloimmunity from Differences in Donor and Recipient HLA Surface Electrostatic Potential. Journal of immunology, 2018, 201 (12): 3780-3792.
[52] KOSMOLIAPTSIS V, CHAUDHRY AN, SHARPLES LD, et al. Predicting HLA class I alloantigen immunogenicity from the number and physiochemical properties of amino acid polymorphisms. Transplantation, 2009, 88(6): 791-798.
[53] KOSMOLIAPTSIS V, SHARPLES LD, CHAUDHRY AN, et al. Predicting HLA class II alloantigen immunogenicity from the number and physiochemical properties of amino acid polymorphisms. Transplantation, 2011, 91(2): 183-90.这个页数信息是否有误?
[54] WIEBE C, KOSMOLIAPTSIS V, POCHINCO D, et al. A Comparison of HLA Molecular Mismatch Methods to Determine HLA Immunogenicity. Transplantation, 2018, 102(8): 1338-1343.
[55] 肾移植肾脏移植人类白细胞抗原分型和抗体检测专家共识. 中华医学杂志, 2022, 102(10): 704-716.
[56] CAI J, TERASAKI PI. Human leukocyte antigen antibodies for monitoring transplant patients. Surg Today, 2005, 35(8): 605-612.
[57] TERASAKI PI, MCCLELLAND JD. Microdroplet assay of human serum cytotoxins. Nature, 1964, 204: 998-1000.
[58] PATEL R, TERASAKI PI. Significance of the positive crossmatch test in kidney transplantation. N Engl J Med, 1969, 280(14): 735-739.
[59] ALTERMANN WW, SELIGER B, SEL S, et al. Comparison of the established standard complement-dependent cytotoxicity and flow cytometric crossmatch assays with a novel ELISA-based HLA crossmatch procedure. Histology and histopathology, 2006, 21(10): 1115-1124.
[60] THISTLETHWAITE JR, BUCKINGHAM M, STUART JK, et al. T cell immunofluorescence flow cytometry cross-match results in cadaver donor renal transplantation. Transplant Proc, 1987, 19(1 Pt 1): 722-724.
[61] TAKEDA A, UCHIDA K, HABA T, et al. Acute humoral rejection of kidney allografts in patients with a positive flow cytometry crossmatch (FCXM). Clin Transplant, 2000, 14 (3): 15-20.
[62] CAI J, QING X, TAN J, et al. Humoral theory of transplantation: some hot topics. British Medical Bulletin, 2013, 105(1):139–155.
[63] TAMBUR AR, WIEBE C. HLA diagnoztics: evaluating DSA strength by titration. Transplantation, 2018, 102: S23-S30.
[64] KOEFOED-NIELSEN P, MOLLER BK. Donor-specific anti-HLA antibodies by solid phase immunoassays: advantages and technical concerns. Int Rev Immunol, 2019, 38 (3): 95-105.
[65] MALHEIRO J, TAFULO S, DIAS L, et al. Analysis of preformed donor-specific anti-HLA antibodies characteristics for prediction of antibody-mediated rejection in kidney transplantation. Transpl Immunol, 2015, 32 (2): 66-71.
[66] MORRIS AB, SULLIVAN HC, KRUMMEY SM, et al. Out with the old, in with the new: Virtual versus physical crossmatching in the modern era. HLA, 2019, 94 (6): 471-481.
[67] TERASAKI PI, MCCLELLAND JD. Microdroplet assay of human serum cytotoxins. Nature, 1964, 204: 998-1000.
[68] TERASAKI PI, CAI J. Human leukocyte antigen antibodies and chronic rejection: from association to causation. Transplantation, 2008, 86(3): 377-383.
[69] CAI J, TERASAKI PI, ANDERSON N, et al. Intact HLA not beta2m-free heavy chain-specific HLA class I antibodies are predictive of graft failure. Transplantation, 2009, 88(2): 226-30.
[70] 中华人民共和国国家卫生健康委员会. WS/T 494-2017 临床定性免疫检验重要常规项目分析质量要求[EB/OL].
[71] 中国合格评定国家认可委员会. CNAS-GL038:2019临床免疫学定性检验程序性能验证指南[EB/OL].
[72] 何军, 吴德沛. 我们如何做好抗HLA抗体检测的质量控制.中华血液学杂志, 2019, 4(40): 265-269.
[73] 何军, 袁晓妮. 如何应用Luminex技术做好抗HLA抗体的临床检测. 临床检验杂志, 2019, 37(11): 801-805.
[74] CECKA JM. Calculated PRA (CPRA): the new measure of sensitization for transplant candidates. Am J Transplant, 2010,10(1): 26-29.
[75] TINCKAM KJ, LIWSKI R, POCHINCO D, et al. cPRA Increases With DQA, DPA and DPB Unacceptable Antigens in the Canadian cPRA Calculator. Am J Transplant, 2015,15(12): 3194-3201.
[76] SYPEK MP, KAUSMAN JY, WATSON N, et al. The Introduction of cPRA and Its Impact on Access to Deceased Donor Kidney Transplantation for Highly Sensitized Patients in Australia. Transplantation, 2021,105(6): 1317-1325.
[77] JANG JY, KIM YJ, KIM Y, et al. Application of calculated panel reactive antibody using HLA frequencies in Koreans. Ann Lab Med, 2012, 32(1): 66-72.
[78] CHAN YP, WONG MWK, TANG LWM, et al. A simplified method of calculating cPRA for kidney allocation application in Hong Kong: a retrospective study. Transpl Int, 2017, 30(12): 1234-1242.
[79] LIMA BA, ALVES H. Portuguese calculated panel reactive antibodies online estimator. HLA, 2019, 93(6): 445-450.
[80] ASENSIO E, LÓPEZ-HOYOS M, ROMÓN Í, et al. Assessment of Spanish Panel Reactive Antibody Calculator and Potential Usefulness. Front Immunol, 2017, 8: 540.
[81] KRANSDORF EP, PANDO MJ, STEWART D, et al. Stem cell donor HLA typing improves CPRA in kidney allocation. Am J Transplant, 2021, 21(1): 138-147.
[82] MONTGOMERY RA, TATAPUDI VS, LEFFELL MS, et al. HLA in transplantation. Nat Rev Nephrol, 2018, 14(9): 558-570.
[83] LEFAUCHEUR C, LOUIS K, PHILIPPE A, et al. The emerging field of non-human leukocyte antigen antibodies in transplant medicine and beyond. Kidney Int, 2021, 100(4): 787-798.
[84] SOROHAN BM, BASTON C, TACU D, et al. Non-HLA Antibodies in Kidney Transplantation:Immunity and Genetic Insights. Biomedicines, 2022, 10 (7): 1506.
[85] ZHANG Q, REED EF. The importance of non-HLA antibodies in transplantation Non-HLA Antibodies in Kidney Transplantation: Immunity and Genetic Insights. Nat Rev Nephrol, 2016, 12(8): 484-495.
[86] CARAPITO R, AOUADI I, VERNIQUET M, et al. The MHC class I MICA gene is a histocompatibility antigen in kidney transplantation Non-HLA Antibodies in Kidney Transplantation: Immunity and Genetic Insights. Nat Med, 2022, 28(5): 989-998.
[87] MESNARD L, MUTHUKUMAR T, BURBACH M, et al. Exome Sequencing and Prediction of Long-Term Kidney Allograft Function. PLoS Comput Biol, 2016, 12 (9): e1005088.
[88] TAMBUR AR, BESTARD O, CAMPBELL P, et al. Sensitization in transplantation: Assessment of Risk 2022 Working Group Meeting Report. American Journal of Transplantation, 2023, 23:133–149.
[89] REINDL-SCHWAIGHOFER R, HEINZEL A, KAINZ A, et al. Contribution of non-HLA incompatibility between donor and recipient to kidney allograft survival: genome-wide analysis in a prospective cohort. Lancet, 2019, 393 (10174): 910-917.
[90] ZHANG Z, MENON MC, ZHANG W, et al. Genome-wide non-HLA donor-recipient genetic differences influence renal allograft survival via early allograft fibrosis. Kidney Int, 2020, 98 (3): 758-768.