《中国肾脏移植临床诊疗指南》之53
中国肾脏移植受者隐球菌病临床诊疗指南
中华医学会器官移植学分会
【摘要】为进一步规范中国肾脏移植受者隐球菌病的诊断和治疗,中华医学会器官移植学分会组织肾脏移植专家、感染病学等专家在《器官移植受者侵袭性真菌病临床诊疗技术规范》(2019版)的基础上,参考国内外新近的相关研究成果、专家共识、指南和成熟的临床经验,结合我国肾脏移植受者隐球菌病诊治的临床现状,制定《中国肾脏移植受者隐球菌病临床诊疗指南(2023 版)》,以期为中国肾脏移植受者隐球病临床诊疗提供理论及临床实践参考,旨在改善及促进肾脏移植质量的提升。
【关键词】肾脏移植;隐球菌;感染;临床特征;诊断;治疗;免疫抑制;指南
隐球菌病是由新型隐球菌(cryptococcus neoformans)感染引起的一种亚急性或慢性真菌病,2种常见的主要临床类型有隐球菌性脑膜炎(cryptococcal meningitis, CM)和肺隐球菌病(pulmonary cryptococcosis, PC)。隐球菌病是实体器官移植(solid organ transplant, SOT)受者中第三种常见的侵袭性真菌感染,而在肾脏移植受者中隐球菌病更为常见在SOT侵袭性真菌病中位居第2位[1-3]。隐球菌属中新型隐球菌最为常见,新型隐球菌包括两个变种,即新型隐球菌新生变种和格特变种;前者广泛分布于世界 ,后者主要分布于热带、亚热带地区。在免疫功能正常的人群中感染率约为十万分之一,在免疫抑制患者中的感染发病率约为5%~10%,隐球菌可以感染人体的任何组织和脏器,常见的部位是中枢神经系统、肺部和皮肤,健康人对该真菌有免疫力,只有当机体免疫机制削弱、抵抗力降低时,病原菌才易于侵入人体致病。隐球菌病好发于艾滋病(acquiredImmune deficiency syndrome, AIDS)、糖尿病、晚期肿瘤、系统性红斑狼疮(systemic lupus erythematosus, SLE)等患者,肾脏移植受者可能合并这些疾病,或肾脏移植受者由于多种免疫抑制剂组合应用,尤其是一些移植受者反复进行抗排斥反应治疗,大剂量激素及多种抗B细胞和抗浆细胞抗体的应用,或长期维持性免疫抑制剂应用处于免疫抑制过度水平,都将使隐球菌病发病风险增加。
基于肾脏移植受者隐球病诊治的复杂性,需要建立规范的诊疗程序并提供更为优化的诊断与防治建议,为此,中华医学会器官移植学分会组织器官移植专家,感染病学等专家,在《器官移植受者侵袭性真菌病临床诊疗技术规范》(2019版)的基础上,参考国内外新近研究结果及相关指南,并结合相关领域移植中心肾脏移植专家、感染病学专家的临床成熟经验,制定《肾脏移植受者隐球病临床诊疗指南》(以下简称“指南”),以促进和改善肾脏移植受者和移植肾长期存活。
一、指南形成方法
本指南已在国际实践指南注册与透明化平台(Practice Guide Registration for TransPAREncy, PREPARE)上以中英双语注册(注册号:PREPARE2023CN838)。
指南范围及临床问题的确定:首先通过指南专家会议对临床关注的问题进行讨论,最终选择出本指南拟解决的临床问题,并聚焦隐球菌病诊断和治疗应用两大主要方面。
证据检索与筛选:按照人群、干预、对照、结局(population, intervention, comparison, outcome, PICO)的原则对纳入的临床问题进行检索,检索MEDLINE(PubMed)、Web of Science、万方知识数据服务平台和中国知网数据库,纳入指南、共识、规范、系统评价和Meta分析,随机对照实验(randomized controlled trial, RCT)、非RCT队列研究和病例对照研究等类型的证据。检索词包括:“器官移植”、侵袭性真菌病“、“隐球菌病”、“风险因素”、“诊断”、“治疗”、“预防”、“免疫重建炎症综合征”等。
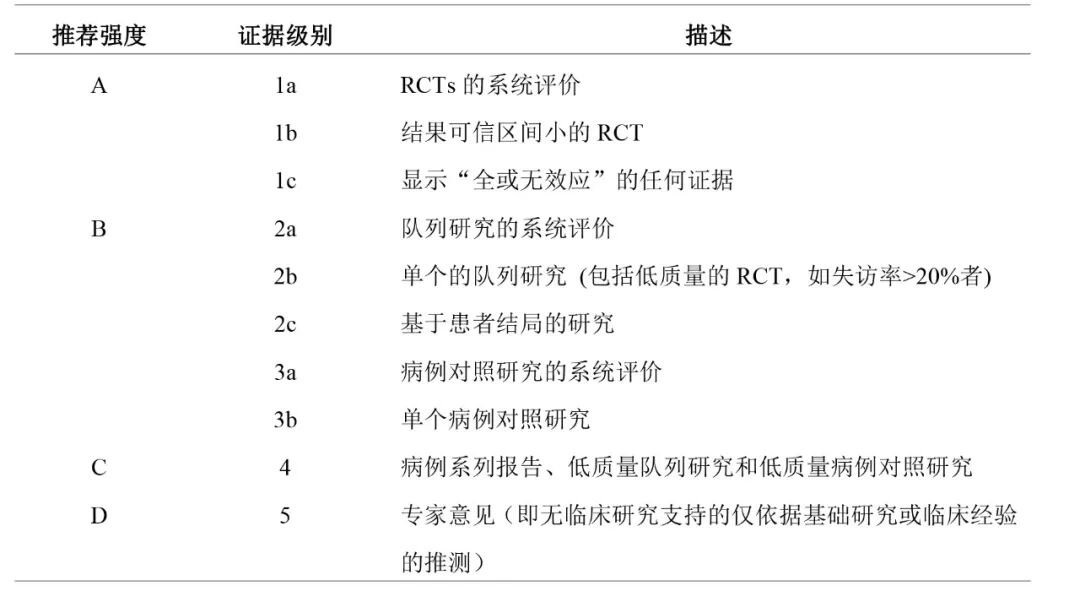
证据分级和推荐强度分级:本指南采用2009牛津大学证据分级与推荐意见强度分级标准对推荐意见的支持证据体进行评级(表1)。
推荐意见的形成:综合考虑证据以及我国肾脏移植现状及临床可操作性和利弊等因素后,形成初稿经多轮组专家会议充分讨论,指南工作组确定了符合我国国情的肾脏移植受者隐球菌病临床诊疗的19条推荐意见。经中华医学会器官移植学分会组织全国器官移植与相关学科专家两轮会议集体讨论,根据其反馈意见对初稿进行修改,最终形成指南终稿。
表1 2009牛津大学证据分级与推荐意见强度分级标准
二、流行病学
隐球菌是一种存在于土壤、树木和鸟粪中的环境真菌,它既能感染免疫正常的宿主,也能感染免疫抑制的宿主。在SOT受体中发生隐球菌病通常是“静止感染“的再激活。然而,流行病学调查显示,器官移植后也会发生原发性感染。实体器官移植受者中,隐球菌病的总体发生率为0.2%~5%;在接受SOT的患者中,约8%的侵袭性真菌感染是由于隐球菌病引起[2]。隐球菌病发病的一个重要特点是表现为晚发感染,多见于移植1年后,发病的中位时间为移植后16~21个月。与肾脏移植受者相比,肝移植和肺移植受者发病时间通常更早(<12个月)。隐球菌感染也可通过捐赠的器官或组织进行传播;当肾脏移植后30天内移植受者发生隐球菌感染,当一个供者的多个器官在多个移植受者中被诊断为隐球菌病,或者在手术或移植部位发现隐球菌病时,应考虑供者源性隐球菌病[2]。
免疫抑制是隐球菌病的重要危险因素。在所有非HIV感染的宿主中,糖皮质激素的应用与隐球菌病的风险增加相关。T细胞耗竭性抗体,如阿仑单抗和抗胸腺细胞球蛋白,可引起淋巴细胞亚群CD4+ T细胞的严重耗竭,并与隐球菌病的风险增加相关;未接受阿仑单抗或抗胸腺细胞球蛋白治疗的SOT受者隐球菌病累积发生率为0.3%,接受单剂量治疗的为1.2%,接受≥1个剂量治疗的为3.5% (P=0.04);与诱导治疗相比,接受阿仑单抗抗排斥治疗的SOT受者更容易发生侵袭性真菌感染。钙调磷酸酶抑制剂(CNI)似乎不影响发病率,且应用CNI治疗方案的患者发生感染后与较低的播散性疾病发生率相关[4]。一项对42 634名SOT患者中隐球菌病的危险因素进行的多变量分析显示:老年患者、糖尿病患者或经济情况较差患者隐球菌感染风险增加[2]。
三、 临床特点及诊断
肾移植受者隐球菌病诊断的一个重要目的是确定疾病的部位和程度,因为这有助于确定抗真菌药物的选择和治疗时间。肾脏移植临床隐球菌病主要包括:①肺隐球菌病,②隐球菌脑膜炎,③其他部位隐球菌病(皮肤、软组织、骨、关节、腹部内脏器官等),具有不同临床特征。
免疫功能低下的肾脏移植受者或合并有自身免疫性疾病、移植前长期免疫抑制剂治疗、HIV/AIDS、淋巴瘤、实体肿瘤化疗等风险因素,出现发热,咳嗽、呼吸急促、咯血等呼吸道症状,肺CT提示肺部病变,应高度怀疑是肺隐球菌病。
临床问题1:肾脏移植受者肺隐球菌病应如何检查确诊,如何排除合并播散性感染及中枢神经系统隐球菌病?
推荐意见1:对怀疑为肺隐球菌病的肾脏移植受者,推荐行隐球菌荚膜抗原(首选胶体金免疫层析法)及其它病原学检查,以确定诊断,及时治疗(推荐强度B,证据等级2a)。
推荐意见2:肺隐球菌病肾移植受者如血液隐球菌荚膜抗原试验阳性,建议作血培养及腰椎穿刺病原学检查以尽快明确有无隐球菌血流播散性感染或中枢神经系统隐球菌病,以利精准治疗(推荐强度B,证据等级2b)。
肾移植受者肺部隐球菌病表现多不典型,从无症状或症状不明显到明显临床表现[2,5-7]:发热、咳嗽、不适、盗汗、体重减轻和呼吸困难,以及伴有呼吸衰竭的严重肺炎;肺部隐球菌病的影像学常表现为单发(33%的患者)或多发结节,不常见的影像学表现包括结节(可被误诊为肺肿瘤) 、大叶实变或积液。因而,临床表现结合隐球菌病原学检查对确定诊断十分重要[7-9];痰、肺泡灌洗液(bronchoalveolar lavage fluid,BALF)、支气管刷片、细针抽吸物或肺活检切片的隐球菌染色、镜检和培养,血培养、组织病理等检查是病原学诊断的重要依据,BALF及血液隐球菌荚膜抗原检测 (cryptococcus antigen, CrAg)、 宏基因组高通量测序(metagenomic next-generation sequencing,mNGS),具有快速简便诊断的优势,尤其是隐球菌荚膜抗原检测胶体金免疫层析法(侧流免疫层析法, lateral flow assay, LFA)具有很高的敏感性和特异性[10],有助快速诊断。由于不同部位的隐球菌病治疗方案不同,因而,如发现血隐球菌荚膜抗原试验阳性,应及时作血培养及腰椎穿刺病原学检查以尽快明确有无隐球菌血流播散性感染或中枢神经系统(central nervous system, CNS)隐球菌病,以利精准治疗。
隐球菌感染致中枢神经系统疾病通常表现为脑膜炎,患者表现头痛、发热、恶心、呕吐,精神错乱等中枢神经系统症状,可并发肺炎或有其他弥散性疾病的证据,或局灶性皮肤病变,但最常见的是孤立的中枢神经系统感染,无其他疾病表现。
临床问题2:疑似隐球菌脑膜炎的肾脏移植受者应如何做进一步检查确诊?
推荐意见3:对疑似隐球菌脑膜炎的肾脏移植受者,除进行颅脑影像学检查外,建议尽快进行有助于确定诊断的检查包括脑脊液、血液隐球菌荚膜抗原检测(首选LFA)及其它病原学检查(推荐强度B,证据等级2a)。
肾脏移植受者尤其处于免疫功能低水平状态时,出现头痛、发热、精神错乱、视力和听力障碍等中枢神经系统症状,要高度怀疑为隐球菌脑膜炎,对于脑部隐球菌病影像学检查MRI的灵敏度高于CT,主要表现为肉芽肿性病变、囊肿样改变、脓肿性病变或血管炎性病变,确定诊断应进行特殊专项检查;包括腰椎穿刺脑脊液检查、脑脊液隐球菌培养、脑脊液墨汁染色、脑脊液隐球菌检测及脑脊液mNGS检测,尽快确定诊断及治疗[2,7,10-12]。目前常用的隐球菌抗原检测方法包括乳胶凝集试验、酶联免疫分析法和胶体金免疫层析法(LFA),常规检测的标本包括血清和脑脊液(cerebro-spinal fluid, CSF)。与培养、病理学检查相比,隐球菌抗原检测具有快速、简便的优势,同时具有很高的敏感性和特异性。Meta分析发现,LFA诊断隐球菌感染的总体敏感性和特异性分别为97.6%和98.1%[10]。对CSF样本进行抗原检测具有高敏感性和特异性(97%和93%~100%),当CSF不能检测时,可以用血清进行检测,敏感性为87%[10-11]。LFA成本低,简便,准确度高,可在血清和尿液样本量有限的情况下进行,是一种即时诊断方法。由于对这类人群快速隐球菌筛选试验可以及时诊断与治疗挽救生命,故具有很高的临床应用价值。临床现已将脑脊液、血液样本隐球菌荚膜抗原阳性作为隐球菌感染的确诊指标[2,12-13]。mNGS技术是对标本中全部核酸进行高通量测序,并通过生物信息学分析以识别标本中病原体的检测方法,这种无需培养、无偏好性的病原检测技术目前在临床已普遍应用. mNGS在侵袭性真菌病(invasis fungal disease, IFD)病原学诊断中具有重要临床价值,尤其是免疫功能低下或重症IFD患者、疑难IFD、经验治疗和早期靶向治疗无效的IFD、以及对侵入性手术不耐受的IFD ,mNGS检测可提高中枢神经系统感染性疾病中罕见、新发或特殊的病原体的检出率,缩短诊断时间,及时有效的为患者实现精准诊断与治疗提供科学依据[12-14]。
临床问题3:隐球菌病其它常见感染部位有哪些?应做哪些进一步检查?
推荐意见4:隐球菌病肾脏移植受者,建议高度关注除肺部、CNS以外,皮肤、软组织、骨骼、肝脏、肾脏等其它部位的隐球菌感染,同时作相关检查进行评估(推荐强度B,证据等级2b)。
全身多个部位均可发生隐球菌感染;有研究数据表明[2,14-15],SOT隐球菌病患者中,约50%~75%有肺外或播散性疾病;因而,肾脏移植受者隐球菌病诊断过程中,应高度关注除肺部和CNS以外其它部位的隐球菌病,并进行相关检查评估,包括:血液、尿液、肺泡灌洗液、腰椎穿刺脑脊液、或其他组织培养、以及隐球菌荚膜抗原检测,体液及感染部位mNGS、PCR等检测。除中枢神经系统、肺部外,其它可能发生的常见隐球菌病感染部位包括:皮肤和软组织、肝脏、肾脏、骨骼和关节、前列腺等部位。皮肤隐球菌病可表现为蜂窝组织炎、丘疹、结节或溃疡性病变,大部分病变见于下肢,并与中枢神经系统疾病相关。虽然皮肤病变主要代表血行播散,但皮肤也可能是隐球菌的侵入门户,成为SOT受者播散性疾病的潜在来源。前列腺和肾脏隐球菌感染可能表现为尿液中的酵母菌,需要临床怀疑才能作出进一步明确诊断。
四、治疗
肾脏移植受者隐球菌病的治疗包括四个关键部分:①腰椎穿刺:获取脑脊液病原学检查,用以识别中枢神经系统疾病并评估和管理颅内压,以及协同治疗;②选择合适有效的抗真菌药物治疗;③辅助治疗;④调整免疫抑制状态。
临床问题4:隐球菌脑膜炎肾移植受者进行腰椎穿刺的临床意义?
推荐意见5: 推荐腰椎穿刺获取脑脊液标本作隐球菌病原学检查,不仅有助于中枢神经系统隐球菌感染疾病诊断,且有助于协助治疗以及疗效和预后判断(推荐强度A,证据等级1b)。
约50%~70%的隐球菌脑膜炎患者有颅内压升高(increased intracranial pressure, ICP)[2,14,16],腰椎穿刺应当用于确定中枢神经系统疾病和评估颅内压,以及抗隐球菌药物治疗效果和疾病预后评价。在HIV感染患者中,治疗性腰椎穿刺与69%患者的相对生存改善相关,若脑脊液压力≥25 cmH2O,抗隐球菌诱导治疗时出现颅内压增高症状,应根据需要进行腰椎穿刺减压,目标为把增高的脑脊液压力降低50%,或致正常脑脊液压力(< 20 cmH2O)[2,14,16]。抗隐球菌诱导治疗后2周重复脑脊液检查评估,有助于了解及明确抗真菌治疗的隐球菌清除率,指导临床治疗。
隐球菌病抗真菌药物治疗的选择取决于疾病的部位和程度、肾移植受者净免疫抑制状态和疾病的严重程度。
临床问题5:肾脏移植受者不同类型的隐球菌病抗真菌药物应如何选择及应用?
推荐意见6:建议将两性霉素B脂质体联合氟胞嘧啶作为隐球菌脑膜炎、播散性疾病或重度肺部隐球菌病首选抗真菌药物治疗方案(推荐强度B,证据等级2a)。
推荐意见7:隐球菌脑膜炎治疗包括诱导期、巩固期和维持期;建议诱导期应用两性霉素B脂质体+氟胞嘧啶,疗程至少2周以上;巩固期(8周)、维持期(6~12月)首选氟康唑治疗。(推荐强度B ,证据等级2b)
推荐意见8:建议氟康唑作为无症状或轻度到中度隐球菌感染致肺部疾病的首选抗真菌药物,采用口服400~800mg/d,疗程6~12月(推荐强度B,证据等级2b)。
推荐意见9:当氟康唑不能使用或患者对氟康唑耐药时,建议选择泊沙康唑、艾沙康唑等作为替代药物治疗 (推荐强度B,证据等级2b) 。
尚未见报道在肾脏移植受者中进行抗真菌治疗隐球菌病的随机对照试验。目前的治疗建议是根据HIV感染患者的临床试验和对SOT受者回顾性研究资料。隐球菌病抗真菌药物治疗的选择取决于疾病的部位和程度,患者净免疫抑制状态和疾病的严重程度(包括免疫抑制方案免疫抑制的强度、应用剂量多少、血药浓度高低、个体合并疾病情况:如糖尿病、肾功能不全、外科手术或营养缺乏程度、细胞免疫、体液免疫抑制程度,以及病毒复制载量等)。在开始治疗之前,区分患者是播散性隐球菌疾病还是局限性肺部和无症状疾病,攸关药物选择和治疗方案[2,8,12,16]。基于强效免疫抑制剂应用下的肾移植受者发生隐球菌脑膜炎增加了疾病诊治的复杂性,因而,在治疗策略上应选取当时可用的更为有效及不良反应相对更小、患者可以耐受的抗真菌药物及其组合方案。隐球菌中枢神经系统疾病/隐球菌脑膜炎抗真菌治疗周期通常包含:诱导期(Induction)、巩固期(Consolidation)和维持期(Maintenance)。诱导期首选治疗[17]:两性霉素B脂质体(AmBisome)3~4mg(kg·d)(次选两性霉素B脂质体复合物(ABLC)5mg(kg·d))+ 氟胞嘧啶25mg/kg,qid。诱导期疗程至少2周以上;巩固期:应用氟康唑(400~800mg/d)治疗8周,维期期治疗氟康唑口服(200~400mg /d)6~12个月。
两性霉素B(amphotericin B)是一种强效广谱杀菌剂,是目前抗菌谱最广的抗真菌药物,大多数念珠菌、隐球菌、曲霉、毛霉、镰刀菌、足放线菌属、组织胞浆菌、皮炎芽生菌、马尔尼菲蓝状菌等均对两性霉素B保持较高的敏感率。两性霉素B在1955年首次从结核链霉菌中分离出来,并于同年开始临床应用;两性霉素B与真菌细胞膜上的麦角固醇结合形成孔状的超分子结构,从而产生跨膜的离子通道,造成细胞膜通透性改变,最终导致真菌细胞死亡[18-20]。与传统两性霉素B相比,两性霉素B脂质体的表面荷电性有助于准确识别真菌细胞壁中的β-葡聚糖,使药物迅速聚集在感染部位;脂质体与真菌细胞接触后将两性霉素B单体转移至真菌细胞膜上,有活性的两性霉素B分子与麦角固醇结合,形成孔洞导致胞内物质外泄,从而达到杀灭真菌作用[18,21]。脂质体结构使其对真菌细胞膜的亲和力高于哺乳动物细胞,增强了药物的靶向杀真菌作用,从而有助于进一步提高临床疗效[22]。此外,脂质体结构通过增强中性粒细胞抗真菌杀伤的非氧化机制,有助于进一步产生更有利的抗真菌效应 [23]。
两性霉素B脂质体能有效穿透血脑屏障,清除脑脊液中的隐球菌,多个国际专业学术机构及指南推荐其作为IFD、中枢神经系统真菌感染的一线用药;但仍应注意药物不良反应包括贫血、电解质紊乱、肾功能和输液部位反应等监测。目前国内上市的两性霉素B脂质制剂主要包括脂质体和脂质复合物(两性霉素B胆固醇硫酸酯复合物)2种;其中,通用名称为两性霉素B脂质体的有国产和进口(AmBisome)2种,但说明书中相关信息如规格和适用人群等均有部分差异;两性霉素B脂质体国产与进口的初始剂量相差数倍,国产两性霉素B脂质体的剂量与两性霉素B普通制剂接近,包封状态和包封率的区别会影响给药剂量和药物疗效,在临床应用时应予注意区别。建议根据肾功能情况并参考不同产地的两性霉素B脂质体药物说明书进行应用。
氟胞嘧啶在20世纪50年代被发现,20世纪70年代被用于抗真菌临床治疗,它抑制真菌DNA合成,在机制上具有抑菌作用,虽然其与两性霉素B联合作用可能是协同作用,但其效力不如两性霉素B[24],因此只适合与其他抗真菌剂联合使用。主要的副作用是胃肠道不耐受,表现为腹痛,实验室检查异常,包括转氨酶升高,骨髓抑制:表现为贫血,白细胞减少和血小板减少。
氟康唑也是一种广谱抗真菌药物。于1981年获得专利,现在全球各地应用且价格便宜。氟康唑通过抑制细胞色素P450 (CYP)酶14α-去甲基化酶起作用,真菌细胞对其远比哺乳动物细胞敏感。该药通常耐受性良好,在隐球菌肺炎治疗中可单用氟康唑 400~800mg/d。在隐球菌脑膜炎两性霉素B脂质体不能使用或有严重肾功能不全时,可采用氟康唑800~1200mg/d的应用方法。氟康唑可能引起皮疹和肝酶异常,特别是在治疗隐球菌脑膜炎所需的高剂量时。由于它是CYP同工酶的抑制剂,药物相互作用是常见的,并且经常使治疗复杂化;尤其是肾移植受者应用CNI、mTOR抑制剂时应注意这些免疫抑制剂药物浓度的监测并特别注意增加监测的频率。既往这三种药物以不同的组合用于治疗隐球菌病的不同疾病阶段取得了较好的临床效果。
近年来,隐球菌性脑膜炎应用两性霉素B脂质体“单次大剂量”治疗是一种新尝试,其疗效具有循证医学证据。WHO根据近期发表的AMBITION试验的结果更新了2018年艾滋病感染患者隐球菌性脑膜炎治疗指南《2022 WHO指南:成人、青少年、儿童HIV感染者隐球菌病的诊断、预防和管理》中,建议在治疗开始的前两周“诱导期”调整为首日单次高剂量(10mg/kg)两性霉素B脂质体联合2周的氟胞嘧啶(100mg/(kg·d),每天分4次应用)和氟康唑(成人1200mg/d。儿童和青少年12mg/(kg·d),最大剂量为800mg/d。)作为治疗隐球菌性脑膜炎患者的首选诱导方案[25],以迅速杀灭脑脊液中隐球菌;在接下来的8~10周内采用大剂量氟康唑单药治疗“巩固”;然后是低剂量氟康唑“维持”治疗,以防止复发;这种“两性霉素B脂质体单次大剂量联合治疗”策略,近期一些临床试验显示有效[26,27],并具有较好的成本-效益,但目前尚无中国隐球菌脑膜炎患者应用这一方案的报道,中国肾脏移植受者隐球菌脑膜炎是否适用,有待更多临床资料的积累及验证。
应用氟康唑治疗隐球菌病的患者,当氟康唑不能使用或患者对氟康唑耐药时,选择应用泊沙康唑或艾沙康唑已被一些临床研究证明有效,并使患者获益[1,15,18-19]。
临床问题6:隐球菌脑膜炎应用氟胞嘧啶治疗在肾功能不全时是否需要调整剂量?
推荐意见10:应用氟胞嘧啶治疗的肾移植受者如有肾功能不全应减少剂量,且暂时无其它药物可替代时建议监测氟胞嘧啶血药浓度指导用药(推荐强度B,证据等级2c)。
隐球菌脑膜炎应用氟胞嘧啶治疗,在肾功能不全的情况下需要减少剂量。同时使用肾毒性药物(如两性霉素B)引起的肾功能损害可进一步导致剂量相关的肾毒性,因而在肾功能不全而无其它药物可替代时建议作氟胞嘧啶血药浓度测定指导用药 [2,24]。
临床问题7:隐球菌脑膜炎治疗诱导期抗真菌药物应用,在什么情况下需要延长疗程?
推荐意见11:隐球菌脑膜炎在治疗诱导期如患者仍处于昏迷状态,且颅内压持续升高,抗真菌治疗2周后脑脊液培养结果仍然阳性,建议延长诱导期治疗时间(推荐强度B,证据等级2b)。
诱导治疗的疗程取决于选用的方案、是否存在严重的免疫抑制状态、症状的严重程度及对治疗的反应、是否伴有隐球菌瘤以及脑脊液培养结果等[2,12,16]。理想情况下诱导治疗疗程应根据每2周的脑脊液培养结果,直到培养阴性时才过渡为巩固治疗。但经抗真菌治疗后的脑脊液培养可能需要数周较长时间才能出结果,难以及时确定疗程。过长的诱导期则可能因药物毒副作用抵消诱导期快速杀菌的获益。既往研究多在资源受限区域,通过腰椎穿刺确定脑脊液灭菌的比例较低,往往根据不同人群选择固定时长的诱导及巩固疗程来实施治疗。应用两性霉素B+氟胞嘧啶的标准治疗,60%~90%的HIV感染者在2周时脑脊液培养转为阴性,52.3%的器官移植受者在2周时脑脊液培养转为阴性,针对这两类人群,推荐至少2周的诱导治疗。如果存在神经系统并发症(持续性头痛、癫痫发作、眼部及听觉异常表现等)或隐球菌瘤,或抗真菌治疗2周后脑脊液培养结果仍然阳性,则诱导治疗应持续至少6周[2]。
临床问题8:隐球菌脑膜炎治疗维持期氟康唑疗程如何确定?
推荐意见12:隐球菌脑膜炎治疗维持期氟康唑疗程为6~12月,应根据患者临床病情进展情况及净免疫抑制状态综合评估确定具体治疗时间(推荐强度B,证据等级2b)。
隐球菌脑膜炎维持治疗的目的主要是避免复发,应结合患者临床病情进展情况及净免疫抑制状态综合评估确定氟康唑治疗时间。隐球菌脑膜炎治疗维持期首选氟康唑200~400mg/d,文献资料显示,HIV感染者需要至少12个月疗程,非HIV感染者需要6~12个月疗程。长期服用高剂量免疫抑制剂者、存在隐球菌瘤者可能需要延长治疗。巩固和维持治疗后的复发率极低。HIV感染者未经维持治疗的复发率为15%~27%,完成维持治疗的复发率为0~7%。器官移植受者完成6~12个月维持治疗,复发风险为1.3%[2]。
临床问题9:严重肺部隐球菌病,唑类抗真菌药不能使用,可采用什么治疗方案?
推荐意见13:严重肺部隐球菌病,如唑类抗真菌药不能使用时,建议采用中枢神经系统隐球菌病抗真菌药物治疗方案(推荐强度B,证据等级2b )。
对播散性隐球菌病和重症肺隐球菌病,国内外指南一致建议采用相同免疫背景下中枢神经系统隐球菌病同样的全身抗真菌治疗方案[17],即:两性霉素B脂质体(AmBisome)3~4mg/(kg·d)(次选两性霉素B脂质体复合物,ABLC 5mg/(kg·d)+氟胞嘧啶25mg/kg,qid。诱导期疗程至少2周以上。
临床问题10:隐球菌脑膜炎应用糖皮质激素作为辅助治疗,是否有助于改善预后?
推荐意见14:糖皮质激素作为急性隐球菌脑膜炎的一种辅助治疗,对降低感染严重程度及死亡率影响有不同临床证据,应综合考虑患者是否治疗获益而应用,一般不建议糖皮质激素临床常规使用(推荐强度B,证据等级2c)。
糖皮质激素(如地塞米松)作为治疗急性隐球菌性脑膜炎的辅助治疗效果有不同临床证据。在一项针对HIV感染的隐球菌脑膜炎患者的大型随机对照试验中,与安慰剂相比,在标准治疗中加入地塞米松导致脑脊液隐球菌清除速度减慢,严重感染增加,且对死亡率没有影响[28]。目前没有关于器官移植受者治疗获益的临床数据,一些临床研究数据表明[29]在隐球菌感染清除后应用糖皮质激素可能获得临床益处。
临床问题11: 隐球菌病治疗期间,移植受者出现“免疫重建炎症综合征”的原因是什么?
推荐意见15:隐球菌病尤其是隐球菌脑膜炎治疗期间,免疫抑制剂的快速减量或停用,可能导致“免疫重建炎症综合征”或移植肾排斥反应,可引起误诊,建议引起移植临床特别关注(推荐强度B,证据等级2b)。
免疫重建炎症综合征(immune reconstitution inflammatory syndrome, IRIS):临床证据显示,在抗真菌药物治疗期间,快速免疫抑制剂减量甚至撤除,致使宿主免疫力恢复,特别是快速突然的恢复,可能会产生不良后果,当达到一个阈值时,在SOT受者中可能因免疫重建而发生严重的症状性疾病,导致“免疫重建炎症综合征”的发展,其临床表现类似于隐球菌病的恶化[30-36];其生物学机制:被认为是在停止或快速减少免疫抑制剂时免疫内环境出现逆转,淋巴细胞Th2转变成Th1、Th17为主的促炎反应[2]。
临床问题12: 隐球菌病治疗期间,如何预防IRIS发生?
推荐意见16:在抗真菌药物治疗同时调整免疫抑制剂用量,建议采用逐渐减少免疫抑制剂用量达到合适水平、避免停用CNI,适量应用CNI对隐球菌病治疗具有协同作用,并有助于防止IRIS和移植肾排斥反应(推荐强度B,证据等级2c)。
隐球菌病治疗的一个重要环节是注意降低免疫抑制的程度。在治疗期间应注意减轻患者的净免疫抑制状态。临床证据表明免疫抑制剂的快速减少尤其是钙调磷酸酶抑制剂大幅降低甚至停用,可能导致“免疫重建炎症综合征” 或急性移植肾排斥反应的出现[2],使患者的病情变得复杂。在抗真菌药物治疗的同时逐渐减少免疫抑制剂用量[2,30-31]以达到临床理想的水平,有助于预防IRIS发生。
临床问题13: 对疑似发生IRIS的患者,在治疗前应注意排除哪些病症?
推荐意见17:对疑似IRIS的患者,建议在治疗前结合临床表现、隐球菌荚膜抗原等病原学检查以及其它相关辅助检查,排除隐球菌病复发或隐球菌病进展恶化(推荐强度B,证据等级2b)。
抗真菌治疗过程中如免疫抑制剂用量给予迅速减少或甚至停用,可能导致“免疫重建炎症综合征”的发展,其临床表现类似于隐球菌病的恶化[30-36];IRIS可能表现为淋巴结炎、蜂窝织炎、无菌性脑膜炎、脑肿瘤性病变、脑积水或肺结节。临床上,中枢神经系统隐球菌病发生IRIS患者,腰椎穿刺其蛋白水平≤50mg/dl、白细胞水平< 2.5x106/L,且病原学检查不支持隐球菌病复发或恶化。IRIS的特点:①症状发生在接受适当的抗真菌治疗期间,不能用新获得性感染来解释;②在出现炎症表现的诊断过程中,新型隐球菌培养结果为阴性;③生物学机制:被认为是快速免疫抑制剂减量或撤除,导致免疫内环境紊乱,从免疫低反应/免疫耐受转向促炎反应为主的免疫活化状态[2]。
临床问题14: 隐球菌病治疗期间,肾脏移植受者出现IRIS如何治疗?
推荐意见18:隐球菌病治疗期间,移植受者发生IRIS,建议给予糖皮质激素短程治疗,及适量应用CNI,有助于改善预后(推荐强度B,证据等级2c)。
目前,没有实验室指标或临床标准可以明确地诊断IRIS,但如果发生IRIS,排除了隐球菌病感染加重或病情恶化,可酌情使用相当于0.5~1mg/kg强的松剂量的糖皮质激素,在SOT受者隐球菌病相关的IRIS治疗中糖皮质激素短程应用已有成功报道;此外适量应用CNI,也有助于改善预后。但在治疗前排除隐球菌病复发或隐球病感染恶化很重要[2,33,36]。
五、隐球菌病预防
临床问题15:肾移植受者是否需要应用抗真菌药物预防隐球菌病,或进行移植供、受者常规筛查?
推荐意见19:目前肾脏移植受者不建议常规应用抗真菌药物预防隐球菌病,也不建议在移植前对移植受者或供者进行常规筛查(推荐强度B,证据等级3a)。
临床证据显示,由于没有确定特定的隐球菌病高危人群,目前不建议肾移植受者进行常规抗真菌药物应用预防隐球菌病,也不建议在移植前对肾移植受者或供者进行常规筛查[36]。对已经发生隐球菌病在维持期治疗的等待肾移植的患者,氟康唑的维持期治疗疗程通常需要至少12个月[2]。
六、小结
IFD是肾移植术后移植受者常见的重要感染并发症,并严重威胁移植受者生命。器官移植受者免疫抑制剂的应用使真菌感染以及IFD疾病特点及病程变得多变、复杂,其危险因素、发病时间、临床表现和救治措施均与非免疫抑制人群存在明显区别。隐球菌病是肾脏移植受者中位居第2位的常见侵袭性真菌病。本指南结合国内外相关领域的专家共识、指南及部分临床成熟经验,概要介绍了肾脏移植受者隐球菌病流行病学特点、临床特征、病原学检查、诊断及治疗要点及原则,以期为肾脏移植术后隐球菌病的临床诊治提供循证医学依据和理论与实践指导,对加强多学科合作,提高我国肾脏移植整体诊疗水平具有促进意义。生物学、免疫学及医学科学等学科正在快速发展,致使现有的指南仍具有一定的局限性,难以解决不断出现的隐球菌病诊治的临床新问题,有待未来更多循证医学证据充实与完善。将“指南”的应用紧密结合不同个体的病情,以及借鉴最新医学科学发展相关的IFD有效诊治新技术、新方法,将使肾移植患者更多获益。
执笔作者:王祥慧 (上海交通大学医学院附属瑞金医院)
通信作者:
门同义(内蒙古医科大学附属医院)
Email:menty85788117@163.com
王祥慧(上海交通大学医学院附属瑞金医院)
Email:13601723465@163.com
主审专家:薛武军(西安交通大学第一附属医院),门同义(内蒙古医科大学附属医院),朱有华(海军军医大学第一附属医院),陈刚(华中科技大学同济医学院附属同济医院)
审稿专家(按姓氏笔画排序):丁小明(西安交通大学第一附属医院),丁晨光(西安交通大学第一附属医院),王祥慧(上海交通大学医学院附属瑞金医院),王强(北京大学人民医院),丰贵文(郑州大学第一附属医院),巨春蓉(广州医科大学第一附属医院),孙启全(广东省人民医院),冯钢(天津市第一中心医院),朱利平(上海复旦大学医学院附属华山医院),李新长(江西省人民医院),李现铎(山东第一医科大学第一附属医院),宋文利(天津市第一中心医院),陈劲松(东部战区总医院),戎瑞明(上海复旦大学医学院附属中山医院),苗芸(广州南方医科大学附属南方医院),张雷(海军军医大学第一附属医院),黄刚(广州中山大学第一附属医院),周洪澜(吉林大学第一附属医院),金海龙(中国人民解放军第三医学中心),谢续标(中南大学湘雅二医院)
利益冲突:所有作者声明无利益冲突。
参考文献
[1] 中华医学会器官移植学分会.器官移植受者侵袭性真菌病临床诊疗技术规范(2019版).器官移植,2019,10(3):227-236.
[2] BADDLEY JW. FORREST GN; AST Infectious Diseases Community of Practice. Cryptococcosis in solid organ transplantation-Guidelines from the American Society of Transplantation Infectious Diseases Community of Practice. Clin Transplant,2019, Sep;33(9):e13543.
[3] DADWAL SS, HOHL TM, FISHER CE, et al. American Society of Transplantation and Cellular Therapy Series, 2: Management and Prevention of Aspergillosis in Hematopoietic Cell Transplantation Recipients. Transplant Cell Ther, 2021, 27(3):201-211.
[4] PENNINGTON KM, MARTIN MJ, MURAD MH, et al. Risk Factors for Early Fungal Disease in Solid Organ Transplant Recipients: A Systematic Review and Meta-analysis. Transplantation, 2024, 108(4):970-984.
[5] LU Y, DING M, HUANG J, et al. Clinical characteristics and image features of pulmonary cryptococcosis: a retrospective analysis of 50 cases in a Chinese hospital. BMC Pulm Med, 2022, 22(1):137.
[6] HOENIGL M, SALMANTON-GARCIA J, WALSH TJ, et al. Global guideline for the diagnosis and management of rare mould infections: an initiative of the European Confederation of Medical Mycology in cooperation with the International Society for Human and Animal Mycology and the American Society for Microbiology. Lancet Infect Dis, 2021, 21(8):e246-e257.
[7] BRIDI CAVASSIN F, VIDAL JE, BAU-CARNEIRO JL, et al. Characteristics, mortality, associated variables with death, and therapeutic response among HIV-positive, solid organ transplant (SOT), and non-HIV-positive/non-transplant (NHNT) patients with cryptococcosis: First multicenter cohort study in Brazil. Med Mycol, 2023, 3;61(2):myad011.
[8] 谷雷,文文,赖国祥. 肺隐球菌病诊治进展. 中华医学杂志,2020,100( 4) : 317-320.
[9] CHENG KB, WU ZH, LIANG S, et al. Associations of serum cryptococcal antigen with different of clinical characteristics: a comprehensive analysis of 378 pulmonary cryptococcosis patients. Ann Palliat Med, 2021, 10(1):681-693.
[10] VIJAYAN T, CHILLER T, KLAUSNER JD. Sensitivity and specificity of a new cryptococcal antigen lateral flow assay in serum and cerebrospinal fluid. MLO Med Lab Obs, 2013, 45(3):16, 18, 20.
[11] KABANDA T, SIEDNER MJ, KLAUSNER JD, et al. Point-of-care diagnosis and prognostication of cryptococcal meningitis with the cryptococcal antigen lateral flow assay on cerebrospinal fluid. Clin Infect Dis, 2014, 58(1):113-6.
[12] 中国医师协会血液科医师分会, 中国侵袭性真菌感染工作组. 血液病/恶性肿瘤患者侵袭性真菌病的诊断标准与治疗原则(第六次修订版). 中华内科杂志, 2020, 59(10): 754-763.
[13] RAJASINGHAM R, WAKE RM, BEYENE T, et al. Cryptococcal Meningitis Diagnostics and Screening in the Era of Point-of-Care Laboratory Testing. J Clin Microbiol, 2019, 2;57(1):e01238-18.
[14] TARDIEU L, DIVARD G, LORTHOLARY O, et al. Cryptococcal Meningitis in Kidney Transplant Recipients: A Two-Decade Cohort Study in France. Pathogens, 2022, 17;11(6):699.
[15] ZHANG F, ZHOU Y, TANG X, et al. Identification of risk factors for disseminated cryptococcosis in non-hiv patients: a retrospective analysis. Eur J Med Res, 2023, 19;28(1):612.
[16] SKIPPER C, ABASSI M, BOULWARE DR. Diagnosis and Management of Central Nervous System Cryptococcal Infections in HIV-Infected Adults. J Fungi (Basel), 2019, 19;5(3):65.
[17] 中国医药教育协会真菌病专业委员会. 两性霉素B不同剂型临床合理应用多学科专家共识(2024版). 中华内科杂志, 2024, 63(3): 230-257.
[18] HOO LS. Fungal fatal attraction: a mechanistic review on targeting liposomal amphotericin B (AmBisome) to the fungal membrane . J Liposome Res, 2017,27(3):180-185.
[19] FAUSTINO C, PINHEIRO L. Lipid systems for the delivery of amphotericin B in antifungal therapy . Pharmaceutics, 2020,12(1):29.
[20] MESA-ARANGO AC, SCORZONIL, ZARAGOZA O. It only takes one to do many jobs: amphotericin B as antifungal and immunomodulatory drug . Front Microbiol, 2012,3: 286.
[21] WALKER L, SOOD P, LENARDO MD et al. The Viscoelastic Properties of the Fungal Cell Wall Allow Traffic of AmBisome as Intact Liposome Vesicles. mBio,2018, 6;9(1):e02383-17.
[22] BRUGGEMANN RJ, JENSEN GM and LASS-FLÖRL C. Liposomal amphotericin B—the past. J Antimicrob Chemother, 2022, 77 Suppl 2: ii3–ii10.
[23] ADLER-MOORE J, LEWIS RE, BRÜGGEMANN RJM et al. Preclinical Safety, Tolerability, Pharmacokinetics, Pharmacodynamics, and Antifungal Activity of Liposomal Amphotericin B. Clinical Infectious Diseases, 2019,68(S4):S244–59
[24] SIGERA LSM, DENNING DW. FLUCYTOSINE and its clinical usage. Ther Adv Infect Dis,2023, Apr 5;10:20499361231161387. doi:
[25] World Health Organization . Guidelines for the diagnosis, prevention, and management of cryptococcal disease in HIV-infected adults, adolescents and children. Available at:
https://apps.who.int/iris/bitstream/handle/10665/260399/9789241550277-eng.pdf. Accessed 25 October 2022.
[26] HARRISON TS, LAWRENCE DS, MWANDUMBA HC, et al. How Applicable Is the Single-Dose AMBITION Regimen for Human Immunodeficiency Virus-Associated Cryptococcal Meningitis to High-Income Settings? Clin Infect Dis, 2023, 4;76(5):944-949.
[27] KANG H, UY JP, HOCC, et al. Safety of Single High-Dose Liposomal Amphotericin B for Induction Treatment of Cryptococcal Meningitis and Histoplasmosis in People With HIV: A Systematic Review and Meta-analysis. Open Forum Infect Dis, 2023, Sep 20;10(10):ofad472.
[28] BEARDSLEY J, WOLBERS M, KIBENGO FM, et al. Adjunctive Dexamethasone in HIV-Associated Cryptococcal Meningitis. The New England journal of medicine,2016,374:542–54.
[29] BEARDSLEY J, WOLBERS M, DAY JN, et al.. Dexamethasone in Cryptococcal Meningitis. N Engl J Med, 2016, 14;375(2):189-90.
[30] LANTERNIER F, ChANDESRIS MO, POIREE S, et al. Cellulitis revealing a cryptococcosis-related immune reconstitution inflammatory syndrome in a renal allograft recipient. Am J Transplant, 2007, 7(12):2826-8.
[31] LEGRIS T, MASSAD M, PURGUS R, et al. Immune reconstitution inflammatory syndrome mimicking relapsing cryptococcal meningitis in a renal transplant recipient. Transpl Infect Dis, 2011, 13(3):303-8.
[32] BADDLEY JW, FORREST GN. Cryptococcosis in solid organ transplantation. Am J Transplant, 2013,13(Suppl 4):242‐249.
[33] CANFIELD GS, HENAO-MARTINEZ AF, FRANCO-PAREDES C, et al. Corticosteroids for Posttransplant Immune Reconstitution Syndrome in Cryptococcus gattii Meningoencephalitis: Case Report and Literature Review. Open Forum Infect Dis, 2019, Oct 23;6(11):ofz460.
[34] SINGH N, ALEXANDER BD, LORTHOLARY O, et al. Pulmonary cryptococcosis in solid organ transplant recipients: clinical relevance of serum cryptococcal antigen. Clin Infect Dis, 2008,46(2):e12‐e18
[35] SINGH N, WAGENER MM, CACCIARELLI TV, et al. Antifungal management practices in liver transplant recipients. Am J Transplant, 2008,8(2):426‐431.
[36]GARCIA-VIDAL C, CARRATALA J, LORTHOLARY O,et al. Defining standards of CARE for invasive fungal diseases in solid organ transplant patients. J Antimicrob Chemother, 2019, Mar 1;74(Suppl 2):ii16-ii20.