肝移植术后急性移植物抗宿主病诊疗中国专家共识
(2024版)
中华医学会器官移植学分会
中国医师协会器官移植医师分会
摘要:肝移植术后移植物抗宿主病(GVHD)是一种罕见但致命的并发症,发病率<1%,病死率高达85%。GVHD的发生是因供者T淋巴细胞对受者组织产生的细胞免疫反应,可累及皮肤、胃肠道和骨髓,典型临床表现包括皮疹、发热、腹泻和全血细胞减少。中华医学会器官移植学分会和中国医师协会器官移植医师分会组织行业内专家制订《肝移植术后急性移植物抗宿主病诊疗中国专家共识(2024版)》,对GVHD的发病机制、危险因素、临床表现、诊断及治疗进行了详细阐述,旨在规范与优化肝移植术后GVHD的临床诊断与治疗,并提出诊断流程和治疗建议,以期改善肝移植术后GVHD受者预后。
【关键词】肝移植;急性移植物抗宿主病;诊断;治疗;共识
Chinese expert consensus on the diagnosis and treatment of acute graft-versus-host disease after liver transplantation (2024 edition)
Branch of Organ Transplant of China Medical Association, Branch of Organ Transplant Physicians of Chinese Medical Doctor Association
【Abstract】 Graft versus-host disease (GVHD) after liver transplantation is a rare but fatal complication, with the incidence rate oF<1% and mortality of 85%. The occurrence of GVHD is due to the cellular immune response of donor T lymphocytes to recipient tissues, which can affect the skin, gastrointestinal tract, and bone marrow. The typical clinical manifestations of GVHD include rash, fever, diarrhea, and decreased whole blood cells. The Branch of Organ Transplant of China Medical Association, combined with Branch of Organ Transplant Physicians of Chinese Medical Doctor Association organize experts to develop the " Chinese Expert Consensus On The Diagnosis And Treatment Of Acute Graft-Versus-Host Disease After Liver Transplantation (2024 Edition)", which elaborates on the pathogenesis, risk factors, clinical manifestations, diagnosis and treatment of GVHD. The aim is to standardize and optimize the clinical diagnosis and treatment of GVHD after liver transplantation, and to propose diagnostic processes and treatment suggestions to improve the prognosis of GVHD recipients after liver transplantation.
【Key words】Liver transplantation; Acute graft-versus-host disease; Diagnosis; Treatment; Consensus
移植物抗宿主病(graft versus-host disease,GVHD)是肝移植术后罕见的并发症,发病率<1%,具有约85%的极高死亡率。GVHD是由移植物内具有免疫活性的供者WBC对受者组织产生的破坏性细胞免疫反应,通常在术后2~8周发生,可累及皮肤、胃肠道和骨髓。典型的临床表现包括皮疹、发热、腹泻和全血细胞减少。但这些临床表现无特异性,所以GVHD诊断常被延误,通常需要对受累器官行活组织病理学检查确诊GVHD,同时GVHD的治疗存在争议。由于肝移植术后GVHD发病率低,目前大样本临床研究有限,缺乏高质量的循证医学证据,关于肝移植受者术后GVHD的早期诊断及治疗策略尚缺乏统一的规范指南。根据GVHD的发病时间可分为急性和慢性GVHD,慢性GVHD在肝移植中更为罕见。因此,中华医学会器官移植学分会和中国医师协会器官移植分会组织业内专家制订《肝移植术后急性移植物抗宿主病诊疗中国专家共识(2024版)》(以下简称本共识),旨在规范与优化肝移植术后GVHD的临床诊断与治疗。
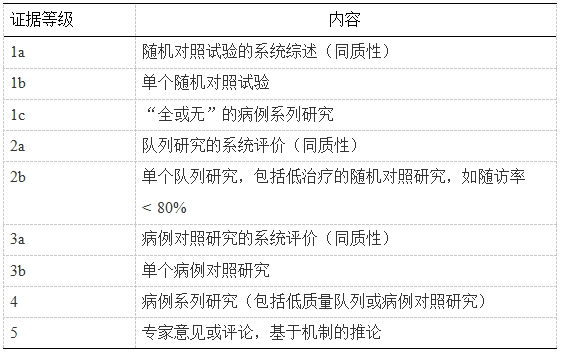
本共识基于推荐分级的评估、制订与评价(grading of recommendations assessment,development and evaluation,GRADE)网格,利用改良的德尔菲法,通过投票表决达成共识。达成共识的投票规则如下(表 1):若除了“0分”以外的任何一格票数超过50%,则视为达成共识,可直接确定推荐意见方向及强度;若“0分”某一侧2格总票数超过70%,亦视为达成共识,可确定推荐意见方向,推荐强度则直接定为“弱”。本共识依据的循证医学证据分级主要参考2009年牛津证据分级,见表 2。
Table 1 Evaluation, formulation, and evaluation for recommended grading
Table 2 Evidence level standards
GVHD的发生是由于具有免疫活性的供者T淋巴细胞激活和克隆扩增后对受者组织产生破坏性的细胞免疫反应[1,2]。供、受者T淋巴细胞和抗原呈递细胞之间的相互作用可导致3种结果:(1)受者对供者产生强烈的免疫反应,导致移植物排斥。(2)供者淋巴细胞占优势并对受者组织产生免疫反应,则发生GVHD。(3)受者和供者之间的免疫反应处于平衡状态,则移植物功能正常,无GVHD和排斥反应发生[3]。因此,GVHD通常发生在免疫受损的受者和移植物具有免疫活性的情况下,但也有报道认为受者的免疫受损状态并不是GVHD发生的先决条件[4]。也有报道认为GVHD可以发生在急性细胞排斥反应之后[5]。
肝移植术后GVHD发病可分为3个阶段[6]。第一阶段是受者由于移植前肝病、手术的生理应激和移植后免疫抑制剂( immunosuppressants,IS)的使用而处于相对低下的免疫状态。第二阶段是供者淋巴细胞在与受者抗原呈递细胞相互作用时被激活,触发IL-2依赖性增殖,主要是Th1分化。第三阶段是细胞毒性供者T淋巴细胞靶向受者组织表达的抗原而导致细胞死亡和组织功能障碍。供者淋巴细胞的进一步激活是由靶向宿主细胞释放的细胞因子介导。“细胞因子-损伤-细胞因子”循环会导致炎症风暴发生,最终导致GVHD发生[7,8]。除此之外,受者皮肤、骨髓和黏膜上皮的破坏进一步加重其免疫受损状态[6]。
(一)人类白细胞抗原(human leucocyte antigen,HLA)配型供、受者HLA位点的匹配率越高,受者对供者产生免疫应答越低,因此肝移植术后GVHD的发生率及病情凶险程度也会增高。供者和受者之间HLA完全匹配是肝移植术后发生GVHD的一个重要危险因素[9,10]。供、受者HLA-B位点而非HLA-A/DR位点的匹配是发生GVHD的重要危险因素[11]。当3~4个HLA-A和HLA-B位点不匹配时,GVHD的相对风险约为1%,0~1个HLA-A和HLA-B位点不匹配的情况下,该比例增加到7%,同时存在0~1个HLA-DR位点不匹配的情况下,该比例增加到12.5%[6]。
由于HLA的家族相容性,在活体肝移植(living donor liver transplantation, LDLT)中GVHD的发生率要高于非亲缘性肝移植。当供者是HLA纯合子而受者是HLA杂合子时(即单向供、受者HLA匹配),两者共享单倍型,受者无法识别并清除供者细胞。相反,供者细胞则可以将另一个未共享的单倍型识别为“异己”并对其进行免疫攻击,所以在LDLT中发生GVHD的风险较高[12]。LDLT后发生致命性GVHD的风险可能取决于供者优势的单向HLA匹配的位点数量,存在所有3个位点(HLA-A、-B和-DR)的错配时GVHD发生率最高[13]。应排除此类供者,并对供者和受者进行移植前HLA配型检查[14]。该种情况在成人LDLT中报道病例较多,而在儿童肝移植中鲜有报道。
(二)供受者年龄因素
受者的年龄也是一个危险因素,随着年龄增长,对供者淋巴细胞的免疫反应可能会丧失[15-17]。年龄> 65岁的受者肝移植术后发生GVHD风险增加9倍[18]。供、受者年龄差较大也是一个危险因素:受者年龄较供者> 40岁,术后GVHD风险增加10倍[4]。而受者年龄比供者年龄大(>20岁)是GVHD的高危因素,同时亦是GVHD后死亡的独立危险因素[19,20]。
(三)受者免疫状态
感染巨细胞病毒和单纯疱疹病毒会使受者免疫状态低下,增加肝移植术后GVHD风险[21]。I型和Ⅱ型糖尿病、各种自身免疫疾病、肝细胞癌所致免疫缺陷状态同样会增加GVHD的风险。此外,酒精性肝病、肝细胞癌合并糖耐量异常,二次移植亦会导致GVHD的高风险[22,23]。受者术前血清中TNF-a和IL-8浓度异常升高,可能提示术后有发生GVHD的风险[24]。使用巴利昔单克隆抗体进行免疫抑制诱导亦是致命性GVHD的独立危险因素[19,20]。通过对受者术前外周血中T细胞(抗原)受体(T cell receptor ,TCR)多样性分析,其结果显示:GVHD受者术前外周血中TCR多样性明显降低,表明受者术前免疫状态较差,对抗原的识别能力降低[24]。肝移植术后再次入院同时合并新型冠状病毒感染的患者,发生GVHD的风险显著升高[23]。新型冠状病毒感染能够引起强烈的炎症风暴,供者来源的免疫细胞在这种炎症风暴的刺激下可能被激活,诱发GVHD。肝移植术后早期感染新型冠状病毒期间发生GVHD的病例已有报道[25]。另一方面,新型冠状病毒感染者的免疫力低下,给GVHD的发生创造了有利条件,肝移植术后早期感染新型冠状病毒,当出现GVHD相似的临床症状时,需要警惕发生GVHD的风险。
推荐意见1:供、受者HLA高度匹配、老年受者、酒精性肝病、肝细胞癌合并糖耐量异常、受者年龄大于供者年龄20岁以上是肝移植术后GVHD的高危因素。同时受者年龄大于供者年龄20岁以上、使用巴利昔单克隆抗体诱导是GVHD后死亡的高危因素。(弱推荐,证据等级:3b)
(四)供者相关因素
研究发现供者既往感染人类嗜T淋巴细胞I型病毒与术后发生GVHD具有极高的相关性[2]。通过使用TCR测序技术对GVHD患者外周血中移植物抗宿主(graft versus⁃host,GVH)T细胞在术前供肝中的来源进行了检测,结果显示:引起GVHD的GVH T细胞可能是来自供肝中残余的供者外周血T细胞[24]。所以,供肝获取时,充分灌洗供肝尤为重要。
推荐意见2:供肝获取时应保证充分的灌洗,尽可能去除供肝中残余的外周血;供肝修整时尽量清除供者淋巴结。(强推荐,证据等级:5)
GVHD通常发生在肝移植术后2~8周,受GVHD影响的组织包括皮肤、口咽黏膜、胃肠道和骨髓[26-29]。GVHD具有非特异性的体征和症状,包括发热、皮疹、口腔溃疡、恶心、厌食、水样或血性腹泻和血细胞减少。发热和皮疹是最常见的早期症状,其次是WBC减少,骨髓受累及、严重脓毒症和胃肠道出血是死亡的主要原因[26,30]。国外报道的GVHD相关症状及发生率分别为:皮疹(59%)、发热(43%)、腹泻(36%)、骨髓抑制(30%)[27]。归纳总结国内发表的相关文献,GVHD症状及发生率分别为:发热(99%)、皮疹(99%)、腹泻(65%)和骨髓抑制(93.8%),GVHD患者均有发热和皮疹。受者可先后出现全部或部分上述临床特征。首发症状中,不明原因发热最为常见,随后出现皮疹、骨髓抑制、消化道症状[27-29,31-56]。但上述表现均无特异性,早期与药物过敏、感染性疾病常难以鉴别。因此,当肝移植受者术后出现不明原因发热、皮疹而无明显肝功能损害时,应警惕GVHD的可能。肝移植术后GVHD进展至终末期,最常见的死亡原因是严重感染和多器官功能衰竭。肝移植术后GVHD常表现为肝功能正常,因为移植肝和引起GVHD的免疫活性细胞具有同源性[57-59]。
(一)发热
不明原因高热是肝移植术后GVHD常见的首发症状,体温为38.5~41.0℃,反复多次行细菌学、病毒学及影像学检查,无病原学及支持感染证据[27-29,31,32,51-56]。
(二)皮疹
通常先出现在胸部,并逐渐扩散到躯干、颈部和手臂,可波及手掌和脚掌。皮疹最初为黄色斑丘疹,可发展为大疱和脱皮。皮疹可由红斑到紫色斑点组成,并融合成斑块[6,60]。此皮疹也可能在药物反应、细菌或病毒感染中出现,如中毒性表皮坏死松解和病毒感染,特别是CMV感染[61],应注意鉴别诊断。
(三)消化道症状
主要表现为腹泻和消化道溃疡[62,63]。由于淋巴细胞浸润和肠黏膜破坏,导致肠道吸收能力减弱,轻者仅表现为腹胀和轻度腹泻;重者常呈水样腹泻,每日可达10余次或更甚。黏膜溃疡可累及消化道全程,引起纳差、恶心、呕吐和腹痛等不适。肠道黏膜糜烂、脱落时可出现便血、腹痛等症状。口腔黏膜损伤的特征是红斑和溃疡,与单纯疱疹病毒引起的口腔黏膜炎症状非常相似,常导致受者吞咽疼痛和困难[12]。
(四)骨髓抑制
肝移植术后发生GVHD的患者中骨髓抑制较为常见[61,64,65]。主要原因是供者来源的淋巴细胞攻击和破坏了受者的造血系统。但需注意鉴别诊断:免疫抑制药物如环孢素A,病毒、细菌和真菌感染有时也会出现全血细胞减少的情况。WBC计数和PLT计数会迅速下降。粒细胞集落刺激因子和促血小板生成素具有一定作用,但一般难以逆转。然而,这些变化也取决于GVHD的发病时间和个别免疫抑制药物不同的血液学效应。
根据文献报道和临床医师经验,单纯以皮疹为主要症状的GVHD临床预后最好,其次是以胃肠道为主的GVHD,而以骨髓抑制为主的GVHD患者通常预后较差,死亡率极高[27]。
(五)其他
在造血干细胞移植(hematopoietic stem cell transplantation, HSCT)中,越来越多的证据表明,GVHD除可累及皮肤、消化道、肝脏,其他器官或组织如中枢神经系统、肺、卵巢、睾丸、胸腺、肾脏和骨骼系统也会受到累及,也可能是GVHD的靶器官[66]。目前,在肝移植后GHVD中已有累及中枢神经系统的案例报道,表现为精神状态改变、局灶性神经功能缺损、认知障碍、癫痫发作,甚至昏迷[67,68]。累及呼吸系统可以出现急性呼吸困难、低氧血症和间断发作窒息[48]。以骨痛为首发症状案例也有报道[54]。
目前尚无被广泛接受的GVHD临床或实验室诊断检测方法,其诊断和治疗时间常被延误。通常临床确诊GVHD时,患者状态很差,因此,早期筛查和诊断GVHD尤为关键。各中心诊断肝移植术后GVHD大多基于临床表现,并通过受累器官的组织病理学特征结合嵌合体检测证实。当以上临床表现高度怀疑GVHD时,应进行活组织病理学检查。
(一)组织病理学检查
皮肤活检镜下显示真皮-表皮交界处大量淋巴细胞浸润和细胞凋亡。此外,皮肤活组织病理学检查可观察到上皮基底层空泡变性、表皮淋巴细胞浸润和坏死的嗜酸性角质形成。也可出现表皮海绵增生、基底细胞水肿、角质形成、细胞凋亡、淋巴细胞胞外分泌(包括卫星细胞坏死)以及表皮下裂形成[15]。
根据病理学表现将皮肤损伤程度分为:(1)Ⅰ级为基底层角质形成、细胞空泡形成。(2)Ⅱ级为表皮可见角化不良细胞,基底细胞空泡化明显。(3)Ⅲ级为大量角质细胞坏死,基底层局部形成裂隙。(4)Ⅳ级为表皮全层坏死并与真皮完全分离[69]。
当出现严重腹泻及便血时可考虑行胃肠道活组织病理学检查,直肠和乙状结肠的敏感性相对较高,内镜下可见黏膜红斑、浅表溃疡及周围渗出液;组织病理学可见隐窝细胞凋亡,部分黏膜出现腺脓肿伴黏膜脱落,淋巴细胞浸润增加。尽管胃肠道活组织病理学检查更具特异性,但该操作有创,因此不建议作为使用IS患者的筛查或一线检查[5,15]。此外,后续肠道活组织病理学检查在评估治疗效果方面的作用也尚未确定[70]。GVHD累及胃肠道时,内镜检查表现为非特异性,内镜和组织学评估间存在差异。此外,上消化道受累及比下消化道更常见。由于存在穿孔和出血等风险,肠道活组织病理学检查前应采取预防措施[71]。
骨髓活组织病理学检查常可见以粒细胞系减少为特征的骨髓抑制征象,后期骨髓象呈现发育不良、各系血细胞减少及再生障碍性贫血的表现[72]。
推荐意见3:临床怀疑GVHD时,出现靶器官和(或)组织受累时,尽早行相关器官和(或)组织病理学检查,以明确GVHD诊断。(强推荐,证据等级:4)
推荐意见4:皮肤活组织病理学检查目前仍是诊断GVHD的首选方法。(强推荐,证据等级:4)
(二)嵌合体检测
在具有适当形态学特征的情况下,受累组织内存在供者淋巴细胞浸润可为诊断提供额外证据[24,73,74]。供者淋巴细胞微嵌合(< 1%供者淋巴细胞嵌合)在肝移植受者中比较常见;目前认为微嵌合对免疫耐受和宿主接受移植物很重要[75,76]。相反,GVHD患者在受者组织(皮肤、胃肠黏膜、外周血)中存在供者淋巴细胞大嵌合(> 1%供者淋巴细胞嵌合),范围从1% ~ 80%[11,77,78]。尽管大嵌合状态与GVHD的发生相关,但仍需要结合临床表现才能确诊GVHD;供者嵌合状态的存在与临床表现和组织病理学有关[30]。持续存在的大嵌合体有助于GVHD的诊断,但在没有临床症状和组织学证据的情况下,嵌合体的存在是非特异性的,因此嵌合体仅是一种辅助诊断工具[15,75]。
移植术后3个月内出现不明原因发热,如无其他临床表现和体征,排除感染后,应尽快送检嵌合体检测,以免延误诊断。如先后出现发热、皮疹等高度怀疑GVHD时,应立即送检嵌合体。
检测受者中供者来源的淋巴细胞最常见的方法是通过血清学或PCR技术进行HLA分型,或通过基因组DNA内高度多态性短串联重复序列(short tandem repeat,STR)的PCR进行分析。HLA分型有助于确认嵌合的淋巴细胞来源于移植肝,而不是输血。利用HLA错配抗体,通过流式细胞学方法连续监测术后外周血中T细胞嵌合比例,结果显示:GVHD发病前1~2周外周血中即可检测到供者T细胞大嵌合状态,并且可以检测到GVH T细胞的克隆扩增[24]。这种细胞学层面的嵌合体检测方法具有快速简便的优势。应用STR检测受累及组织样本中供者DNA的方法优于细胞水平嵌合体[79,80]。STR在初始诊断中非常有用,但HLA分型检测更快速。对性别错配的肝移植患者皮肤活组织病理学检查标本,应用荧光原位杂交检测出Y染色体的存在,也可用于GVHD嵌合体的早期诊断[58,81]。
目前嵌合体检测主要方法为STR,时间较长。仅个别医学中心具有STR检测能力,大部分医学中心需将标本送至外部机构检测,检测机构的实验室环境、设备、实验人员的操作方法及送检样本的质量均会影响嵌合体结果,导致不同机构间的STR结果可能存在差异。因此,建议制订STR标准质控流程,提高嵌合体检测的准确率。同时应该积极开发更为简便、易于普及至临床的嵌合体检测方法。
推荐意见5:嵌合体可作为GVHD的辅助诊断。临床怀疑GVHD时,尽早行嵌合体检测,有助于辅助GVHD诊断。常规检测供受者HLA配型的医学中心可使用HLA错配抗体通过流式细胞术对受者外周血中嵌合比例进行初筛,可以一定程度上缩短诊断时间。(强推荐,证据等级:4)
(三)生物标志物检测
开发辅助诊断肝移植术后GVHD的生物学标志物仍然是目前较为活跃的研究领域。多种炎性细胞因子在GVHD的发生、发展中起重要作用,通过密切监测肝移植术后受者外周血中生物学标志物的水平和变化,可能有助于早期筛选GVHD高危受者。
国内研究结果显示:肝移植术后GVHD受者外周血中检测到IL-2、IL-6、IL-8,IL-18、IFN-g水平显著升高,在接受GVHD治疗后,IL-2、IL-18和IFN-g水平下降[47,82]。有研究结果显示:GVHD发病期间受者外周血中供者来源的细胞游离DNA水平显著升高,因此该指标可用于GVHD的快速诊断和治疗反应监测[83]。
开发GVHD相关生物学标志物,不仅可以筛查GVHD高危患者,还可以辅助早期诊断、早期干预,改善预后,但是需要更多的临床与基础研究佐证。
肝移植术后GVHD的诊断常被延误。因GVHD的体征或症状非特异性,所以GVHD与移植相关并发症(如感染和药物不良反应)的鉴别诊断具有挑战性。由于其罕见性和发病时间的可变性,需要高度警惕才能诊断GVHD。为此,本共识提出以下诊断流程(图 1),以便临床医师快速诊断GVHD。
Figure 1 Diagnosis process of acute graft versus-host disease after liver transplantation
参考HSCT后GVHD[84],根据临床症状和体征肝移植术后GVHD可分为4级(表 3)。
根据以上分级进一步将肝移植GVHD分为轻型和重型(表 4)。
Table 3 Classification of graft versus⁃host disease after liv⁃ er transplantation
Table 4 Severity classification of graft versus⁃host disease
注:明显骨髓抑制定义为白细胞计数<1.5 ×109/L,伴或不伴血小板减少,“-”为此项无
GVHD的治疗目标是尽快恢复受者有效的免疫调节,治疗措施主要包括[22,27]:糖皮质激素冲击联合静脉注射免疫球蛋白(intravenous immunoglobulin,IVIG)、免疫抑制剂减量或停用、应用抗体类药物、预防性抗感染、提高受者免疫状态及有效的支持治疗等。但50%~60%的受者糖皮质激素治疗无效,应用抗TNF-a抗体(如依那西普和英夫利昔单克隆抗体)、抗胸腺细胞球蛋白(antithymocyte globulin,ATG)、阿巴西普、CD4+CD25+Foxp3+Treg细胞和人类间充质干细胞等新型治疗方法,可能通过抑制炎症反应、协助清除供者来源T细胞以及调节受者免疫状态等多种不同作用机制对难治性肝移植术后GVHD发挥积极作用。
(一)糖皮质激素联合IVIG
糖皮质激素具有诱导淋巴细胞凋亡和强大抗炎作用,通过控制全身免疫炎症反应,减少靶器官损伤,对改善受者全身症状有效,是治疗肝移植术后GVHD的一线药物[22]。目前尚无指导激素起始剂量的正式研究,报告的剂量各不相同,部分用药计量高达每日15 mg/kg。参考HSCT后GVHD的激素方案,结合肝移植术后GVHD临床经验,临床疑似GVHD时,可先行小剂量激素,即每天2 mg/kg,同时,完善活组织病理学检查及嵌合体检测进行确诊;如确诊GVHD,激素500mg连续冲击治疗3 d,后改为每日2 mg/kg,并在监测治疗反应的同时持续该剂量≥5 d[22]。在糖皮质激素总剂量不变的情况下,给药频率由每日1次改为每日2次,每周减少0.1 mg/(kg·d),减少至15mg/d时,应更加缓慢减少激素用量,直至停用糖皮质激素。
IVIG能够直接增强受者自身被动免疫力,降低大剂量糖皮质激素治疗带来的感染风险,还能通过抑制淋巴细胞功能、降低网状吞噬细胞活性、抑制补体激活和炎症因子释放等途径稳定、协助恢复受者免疫状态[85,86]。不仅如此,IVIG对血液系统造血功能的保护及恢复,在肝移植术后GVHD骨髓抑制的治疗中也起到重要作用[12]。IVIG建议与激素同步使用,用量和持续时间无明确报告,需要进一步明确。
推荐意见6:确诊GVHD时,应立即应用糖皮质激素联合IVIG。(强推荐,证据等级:4)
(二)免疫抑制剂减量或停用
治疗GVHD时减少还是增加免疫抑制剂存在争议。早期研究认为:增加免疫抑制剂的剂量可以有效抑制T细胞激活,抑制供者T细胞活性。但目前更多研究表明减少或停用免疫抑制剂有助于减轻肝移植术后GVHD的病情并提高生存率。其理论依据主要为GVHD时受者的免疫功能处于极度抑制状态,减少或停用免疫抑制剂可以使受者恢复并提高自身免疫力,以提高自身清除供者来源T细胞的能力,需要注意的是,治疗过程中,如GVHD得到缓解时,免疫抑制剂减量可能会增加发生排斥反应的风险[87]。此时应逐渐、缓慢增加免疫抑制剂剂量,必要时辅以CD25单克隆抗体,可降低移植肝发生排斥反应的风险。对于何时恢复免疫抑制剂,目前尚无参考,应综合评估GVHD的临床症状是否被有效控制,嵌合体是否持续下降以及外周血淋巴细胞绝对计数的升高趋势。
推荐意见7:当疑似或确诊GVHD时,免疫抑制剂应减量或停用。(弱推荐,证据等级:4)
(三)抗感染治疗
1.保护性隔离
大多数GVHD患者最终死于难以控制的脓毒血症,避免感染对于GVHD的预后极为重要[88]。肝移植术后GVHD患者大多存在皮肤及黏膜组织的病变,导致机体对外界致病微生物的屏障功能被破坏或丧失,加之骨髓抑制,后期常发展为致死性败血症。
推荐意见8:一旦患者高度怀疑GVHD,尽快启动严格的隔离措施,做好室内空气消毒,限制进出人员,进出物品均应接受严格的消毒,可使用层流床对受者进行隔离,有条件的中心可以将患者转入HSCT舱。(强推荐,证据等级:5)
2.抗感染药物的使用
GVHD相关全血细胞减少的患者发生机会性感染、败血症和死亡的风险增加[88]。因此,应在疾病早期使用强有力的抗感染药物。早期应预防性应用小剂量广谱抗菌药物和抗真菌药物,预防和治疗巨细胞病毒感染尤为重要。尽早留取血、尿、痰及各种引流液标本培养,待有阳性感染证据时,根据药物敏感试验结果针对性更改抗菌药物。口服或静脉给予万古霉素有助于减少肠道菌群移位和内毒素吸收;通过粪菌移植将微生物直接注入患者肠道内,发挥保护肠道作用,对难治性肝移植术后GVHD受者有一定疗效[12]。
推荐意见9:临床高度怀疑GVHD的患者尽早使用广谱抗细菌、抗病毒和抗真菌药物,预防感染。(强推荐,证据等级:4)
(四)抗体类药物
肝移植后GVHD的激素反应率高达83%[63],但是也存在激素耐药型GVHD(以每天2 mg/kg的剂量开始使用激素治疗3 ~ 5d,GVHD相关临床症状无明显改善或病情进展[22]。所以使用激素治疗的同时,以下抗体类药物也可尝试用于肝移植术后GVHD治疗。
IL-2在供者来源的T细胞激活与克隆性扩增中起重要作用,抗IL-2受体单克隆抗体(如达利珠单克隆抗体和巴利昔单克隆抗体)可通过与IL-2受体α链上的CD25抗原特异性结合从而抑制IL-2,进而阻断CD4+T细胞引发的免疫反应[89]。既往有肝移植术后GVHD受者使用巴利昔单克隆抗体治疗成功的案例,提示IL-2受体拮抗剂可能是有效的治疗药物[90,91]。
TNF-a也可能是GVHD的一个治疗靶点,但使用英夫利昔单克隆抗体治疗未获得良好结果,且感染并发症增加[92,93]。
ATG和阿仑单克隆抗体都能通过作用于T细胞表面抗原和消耗CD4+淋巴细胞达到免疫抑制目的[94,95]。ATG已被证明有助于预防GVHD,但对受者总体生存率的影响有限[96]。阿仑单克隆抗体是CD52特异性单克隆抗体,在预防和治疗GVHD方面均有益处[97]。但由于阿仑单克隆抗体免疫抑制更为严重,因此要进行预防性抗病毒治疗,尤其是针对巨细胞病毒和EB病毒。
利妥昔单克隆抗体可通过抑制B细胞生成、减弱B细胞抗原呈递作用及与T细胞相互作用等,达到减轻免疫反应的目的。有研究结果显示:GVHD高危患者应用利妥昔单克隆抗体可使GVHD发生率显著降低,且预后明显改善[98]。
(五)JAK抑制剂
芦可替尼是一种JAK1/2酶的选择性抑制剂,可有效阻断JAK-STAT信号通路激活,在异基因造血干细胞移植后的GVHD治疗中有效[99-101]。近年来,有研究结果显示:应用芦可替尼可阻断JAK1/2,调节下游的IL-6和IFN-γ信号通路,可以减轻同种异体T淋巴细胞对移植受者靶器官的攻击,从而改善肝移植术后GVHD患者预后[102-105]。
抗体类药物和JAK抑制剂的使用大多借鉴于造血干细胞移植后GVHD的治疗,以上药物尽管在肝移植后GVHD的个案报道中均有提及,但仍需要更多的临床循证医学证据验证此类药物在肝移植术后GVHD治疗中的效果和安全性。
(六)其他治疗方法
其他治疗方法包括血浆置换、单倍体相合HSCT、脐带血移植、HLA相同的异基因外周血造血祖细胞移植、体外活化同种异体反应性宿主T细胞的过继转移、抗供者HLA抗体和间充质细胞治疗[16,106-111]。
一旦GVHD累及骨髓,导致受者出现严重的类似于再生障碍性贫血的骨髓衰竭,伴有极高的病死率。已有HSCT成功治疗肝移植术后GVHD的案例报道[112]。评估肝移植受者是否合适接受HSCT时,应考虑GVHD发生时的合并症,同时与HSCT专家进行多学科会诊。在寻找异基因HSCT供者时,需考虑肝移植受者的HLA配型,而不是器官供者的HLA配型。目前关于肝移植行HSCT的报道较少,但供者、受者和造血干细胞供者间HLA错配程度对GVHD和排斥反应的发生无明显影响。
间充质干细胞(mesenchymal stem cells, MSCs)是一类具有自我更新及向间叶细胞起源的各种细胞系分化潜能的非造血系干细胞。MSCs所具有的低免疫原性和免疫调节特性,为其作为临床治疗免疫相关性疾病提供可能。目前,MSCs在造血干细胞移植后GVHD的治疗上显示出良好的疗效[113]。国内已有学者使用输注体外培养扩增的MSCs尝试治疗肝移植术后GVHD,并取得成功[52]。目前使用MSCs治疗肝移植术后GVHD的报道较少,仍需更多的临床循证医学证据验证该方法的疗效和安全性。
近年来,中医药治疗在HSCT相关GVHD的治疗中取得疗效[114,115]。国内学者早在2011年报道使用高丽红参治疗肝移植术后GVHD的成功案例[116]。高丽红参具有提高免疫力、免疫调节、抗氧化、抗疲劳、抗辐射、抗肿瘤和调整人体内分泌系统的功能。临床上可以尝试使用中医药治疗肝移植术后GVHD,为中医药治疗肝移植术后GVHD提供参考。
(七)支持治疗
当出现骨髓抑制时,应立即停用骨髓抑制性的药物,同时应用粒细胞集落刺激因子、促PLT生成素及成分输血对症支持治疗。应用质子泵抑制剂抑制胃酸、保护胃黏膜;保证充分的肠内营养对维持和保护消化道功能十分必要,若患者正常进食受影响,则辅以部分或完全胃肠外营养支持。此外,应对出现的其他并发症采取及时、积极的对症支持治疗。
与重型GVHD比较,轻型GVHD的治疗较为可控,治疗轻型GVHD时,免疫抑制剂适当减停,糖皮质激素应适当减量,预防性应用抗菌药物,对症支持治疗。轻型GVHD可以进展为重型GVHD,需要及时评估GVHD的进展,及时更改治疗方案。肝移植术后重型GVHD的治疗流程见图 2
注:IVIG为静脉注射免疫球蛋白;GVHD为移植物抗宿主病;HSCT为造血干细胞移植
Figure 2 Treatment process for severe graft versus⁃host disease after liver transplantation
对于GVHD,虽然发病率低,但致死率极高。目前尚无1种成功的治疗策略被广泛认可,肝移植术后GVHD的治疗仍具挑战性。对于GVHD早期诊断和新治疗方法,亟待进一步深入研究,鉴于肝移植术后GVHD患者极高的病死率,未来研究重点可能聚焦于预防和避免术后GVHD的发生。对于GVHD高风险人群,术后应个体化调整IS治疗方案,避免受者免疫系统被过度抑制,导致无法抵抗供者免疫细胞攻击。同时,鉴于肝移植术后GVHD低发病率,应鼓励所有移植中心分享病例及经验,进行多中心研究,有助于推动对GVHD的病理生理机制的探索与研究,由此提出新型、特异性的治疗手段,将为改善肝移植术后GVHD受者的预后带来新希望。
《肝移植术后急性移植物抗宿主病诊疗中国专家共识(2024 版)》
[1] Hill GR, Betts BC, Tkachev V, et al. Current Concepts and Advances in Graft-Versus-Host Disease Immunology [J]. Annu Rev Immunol, 2021, 39: 19-49.DOI:10.1146/annurev-immunol-102119-073227.
[2] Shen C, Li Y, Wang B, et al. HTLV-1 infection of donor-derived T cells might promote acute graft-versus-host disease following liver transplantation [J]. Nat Commun, 2022, 13(1): 7368.DOI:10.1038/s41467-022-35111-w.
[3] Zuber J, Sykes M. Mechanisms of Mixed Chimerism-Based Transplant Tolerance [J]. Trends Immunol, 2017, 38(11): 829-43.DOI:10.1016/j.it.2017.07.008.
[4] Smith DM, Agura E, Netto G, et al. Liver transplant-associated graft-versus-host disease [J]. Transplantation, 2003, 75(1): 118-26.DOI:10.1097/00007890-200301150-00022.
[5] Perri R, Assi M, Talwalkar J, et al. Graft vs. host disease after liver transplantation: A new approach is needed [J]. Liver Transplantation, 2007, 13(8): 1092-9.DOI:10.1002/lt.21203.
[6] Taylor AL, Gibbs P, Bradley JA. Acute graft versus host disease following liver transplantation: the enemy within [J]. Am J Transplant, 2004, 4(4): 466-74.DOI:10.1111/j.1600-6143.2004.00406.x.
[7] Hill GR, Koyama M. Cytokines and costimulation in acute graft-versus-host disease [J]. Blood, 2020, 136(4): 418-28.DOI:10.1182/blood.2019000952.
[8] Martinez-Cibrian N, Zeiser R, Perez-Simon JA. Graft-versus-host disease prophylaxis: Pathophysiology-based review on current approaches and future directions [J]. Blood Rev, 2021, 48: 100792.DOI:10.1016/j.blre.2020.100792.
[9] Soejima Y, Shimada M, Suehiro T, et al. Graft-versus-host disease following living donor liver transplantation [J]. Liver Transpl, 2004, 10(3): 460-4.DOI:10.1002/lt.20101.
[10] Uchiyama H, Kayashima H, Matono R, et al. Relevance of HLA compatibility in living donor liver transplantation: the double-edged sword associated with the patient outcome [J]. Clinical transplantation, 2012, 26(5): E522-9.DOI:10.1111/ctr.12019.
[11] Rogulj IM, Deeg J, Lee SJ. Acute graft versus host disease after orthotopic liver transplantation [J]. Journal of Hematology & Oncology, 2012, 5.DOI:10.1186/1756-8722-5-50.
[12] 朱晓璐, 郑树森. 肝移植术后移植物抗宿主病的诊治进展 [J]. 中华移植杂志(电子版), 2019, 13(01): 75-80.DOI:10.3877/cma.j.issn.1674-3903.2019.01.018.
[13] Hirata M, Yagi S, Shindo T, et al. Donor-dominant one-way matching of human leukocyte antigen-A/B/DR alleles predicts graft-versus-host disease following living donor liver transplantation [J]. Hepatology research : the official journal of the Japan Society of Hepatology, 2020.DOI:10.1111/hepr.13579.
[14] Calmus Y. Graft-versus-host disease following living donor liver transplantation: high risk when the donor is HLA‐homozygous [J]. Journal of Hepatology, 2004, 41(3): 505-7.DOI:10.1016/j.jhep.2004.07.003.
[15] Chaib E, Silva FD, Figueira ER, et al. Graft-versus-host disease after liver transplantation [J]. Clinics (Sao Paulo), 2011, 66(6): 1115-8.DOI:10.1590/s1807-59322011000600035.
[16] Pollack MS, Speeg KV, Callander NS, et al. Severe, late-onset graft-versus-host disease in a liver transplant recipient documented by chimerism analysis [J]. Hum Immunol, 2005, 66(1): 28-31.DOI:10.1016/j.humimm.2004.09.014.
[17] Cho E-H, Suh K-S, Yang SH, et al. Acute graft versus host disease following living donor liver transplantation: First Korean report [J]. Hepato-Gastroenterology, 2007, 54(79): 2120-2
[18] 吕国悦, 蒋超, 刘雪岩, 等. 肝移植术后急性移植物抗宿主病研究进展 [J]. 中华肝脏外科手术学电子杂志 2017, 6(2): 144-6.DOI:10.3877/cma.j.issn.2095-3232.2017.02.016.
[19] Elfeki MA, Pungpapong S, Genco PV, et al. Graft-versus-host disease after orthotopic liver transplantation: multivariate analysis of risk factors [J]. Clinical transplantation, 2015, 29(12): 1063-6.DOI:10.1111/ctr.12627.
[20] Kitajima T, Henry M, Ivanics T, et al. Incidence and Risk Factors for Fatal Graft-versus-host Disease After Liver Transplantation [J]. Transplantation, 2021, 105(12): 2571-8.DOI:10.1097/TP.0000000000003607.
[21] Tian M, Lyu Y, Wang B, et al. Diagnosis and treatment of acute graft-versus-host disease after liver transplantation: Report of six cases [J]. World J Clin Cases, 2021, 9(30): 9255-68.DOI:10.12998/wjcc.v9.i30.9255.
[22] Cooper JP, Abkowitz JL. How I diagnose and treat acute graft-versus-host disease after solid organ transplantation [J]. Blood, 2023, 141(10): 1136-46.DOI:10.1182/blood.2022015954.
[23] Huang Y, Wang Y, Chase RC, et al. Incidence and risk factors of graft-versus-host disease after liver transplantation: A national study 2010-2020 [J]. Hepatol Commun, 2023, 7(10).DOI:10.1097/HC9.0000000000000271.
[24] Li M, Song S, Tian G, et al. Expansion kinetics of graft-versus-host T cell clones in patients with post-liver transplant graft-versus-host disease [J]. Am J Transplant, 2022.DOI:10.1111/ajt.17112.
[25] Kiparizoska S, Nguyen V, Rangnekar AS. Graft-vs-Host Disease in a Liver Transplant Patient With COVID-19 Infection [J]. ACG Case Rep J, 2023, 10(1): e00971.DOI:10.14309/crj.0000000000000971.
[26] Wood A, Eghtesad B, Lindenmeyer CC. Graft-Versus-Host Disease After Liver Transplantation [J]. Clin Liver Dis (Hoboken), 2020, 15(2): 81-4.DOI:10.1002/cld.884.
[27] Kneifel F, Vogel T, Bormann E, et al. Graft-versus-host disease following liver transplantation: A systematic review of literature [J]. Hepatol Commun, 2023, 7(10).DOI:10.1097/HC9.0000000000000260.
[28] 曹俊宁, 滕大洪, 许传屾, 等. 肝移植术后移植物抗宿主病3例临床诊疗分析 [J]. 实用器官移植电子杂志, 2022, 10(04): 337-41.DOI:10.3969/j.issn.2095-5332.2022.04.009.
[29] 赵晓飞, 林栋栋, 李宁, 等. 8例肝移植术后急性移植物抗宿主病的诊治体会 [J]. 临床肝胆病杂志, 2018, 34(11): 2392-6.DOI:10.3969/j.issn.1001-5256.2018.11.025.
[30] Taylor AL, Gibbs P, Sudhindran S, et al. Monitoring systemic donor lymphocyte macrochimerism to aid the diagnosis of graft-versus-host disease after liver transplantation [J]. Transplantation, 2004, 77(3): 441-6.DOI:10.1097/01.TP.0000103721.29729.FE.
[31] 王跃, 彭伟, 张洪涛, 等. 肝移植术后移植物抗宿主病六例临床分析 [J]. 腹部外科 2018, 31(1): 42-7.DOI:10.3969/j.issn.1003-5591.2018.01.010.
[32] 王文静, 王博, 刘昌, 等. 肝移植术后急性移植物抗宿主病5例诊治体会 [J]. 西安交通大学学报(医学版), 2023, 44(2): 236-42.DOI:10.7652/jdyxb202302013.
[33] 梁廷波, 汤晓锋, 郑树森, 等. 肝脏移植术后移植物抗宿主病三例报告 [J]. 中华医学杂志, 2004, 84(10): 826-9.DOI:10.3760/j:issn:0376-2491.2004.10.009.
[34] 贺强, 韩东冬, 陈大志, 等. 肝移植后移植物抗宿主病的初步临床探讨 [J]. 肝胆外科杂志, 2006, 14(2): 91-4.DOI:10.3969/j.issn.1006-4761.2006.02.005.
[35] 胡红焱, 姚桂玲, 宋丽洁, 等. 肝移植后发生移植物抗宿主病受者的骨髓象特征 [J]. 中华器官移植杂志, 2008, 29(6): 368-70.DOI:10.3760/cma.j.issn.0254-1785.2008.06.013.
[36] 汤晓锋. 肝移植术后移植物抗宿主病的临床经验总结(附6例报告) [D], 2005.
[37] 吴烈, 孙宁东, 陈小平, 等. 肝移植术后急性移植物抗宿主病的诊治:附一例 [J]. 中华肝胆外科杂志, 2007, 13(2): 130-1.DOI:10.3760/cma.j.issn.1007-8118.2007.02.019.
[38] 周天保, 卢军华, 杨宁, 等. 肝移植术后急性移植物抗宿主病一例 [J]. 临床外科杂志, 2007, (05): 344.DOI:10.3969/j.issn.1005-6483.2007.05.037.
[39] 杨志慧, 刘惠敏. 肝移植术后并发以皮肤组织损伤为主的移植物抗宿主病一例 [J]. 中华器官移植杂志, 2007, (03): 149-.DOI:10.3760/cma.j.issn.0254-1785.2007.03.020.
[40] 马雪平, 王海燕, 焦小杰, 等. 4例肝脏移植术后移植物抗宿主病分析 [J]. 中华肝脏病杂志, 2007, 15(8): 630.DOI:10.3760/j.issn:1007-3418.2007.08.025.
[41] 李志伟, 李超, 马继韬, 等. 肝移植术后急性移植物抗宿主疾病的诊断和治疗(附2例报道) [J]. 中国普外基础与临床杂志
[42] 杜国盛, 石炳毅, 朱志东, 等. 肝移植术后移植物抗宿主病治疗的初步经验(附2例报道) [J]. 解放军医学杂志, 2008, (01): 23-4.DOI:10.3321/j.issn:0577-7402.2008.01.008.
[43] 王爱丽, 张志成, 单毅, 等. 肝移植术后移植物抗宿主病的诊治 [J]. 海军总医院学报, 2008, (03): 135-8.DOI:10.3969/j.issn.1009-3427.2008.03.003.
[44] 郭志丽, 顾军. 肝移植术后急性移植物抗宿主病1例 [J]. 中国麻风皮肤病杂志, 2008, (03): 231-2.DOI:10.3969/j.issn.1009-1157.2008.03.031.
[45] 李立, 冉江华, 曹海鹰, 等. 肝移植后移植物抗宿主病1例临床分析 [J]. 中国普外基础与临床杂志, 2008, (07): 545-6
[46] 吴海俊, 王晟. 肝移植术后移植物抗宿主病一例治疗成功的报告 [J]. 浙江临床医学, 2009, 11(9): 971-3.DOI:10.3969/j.issn.1008-7664.2009.09.037.
[47] 姚桂玲, 李威, 刘爱兵, 等. 肝移植后移植物抗宿主病受者的相关检查结果 [J]. 中华肝脏病杂志, 2009, 17(11): 856-60.DOI:10.3760/cma.j.issn.1007-3418.2009.11.015.
[48] 许一中, 王璐, 赖威, 等. 肝移植后以窒息为主要症状的移植物抗宿主病一例 [J]. 中华器官移植杂志, 2012, 33(6): 2.DOI:10.3760/cma.j.issn.0254-1785.2012.06.015.
[49] 谢森, 唐礼功, 李志雄, 等. 肝移植受者急性移植物抗宿主病的治疗 [J]. 华中科技大学学报(医学版), 2014, 43(3): 344-7.DOI:10.3870/j.issn.1672-0741.2014.03.023.
[50] 马明, 崔玉军, 郭庆军. 肝移植术后移植物抗宿主病(附1例报告) [J]. 外科理论与实践
2014, 19(04): 305-9.DOI:10.3969/j.issn.1007-9610.2014.04.008.
[51] 杨靖波, 于立新, 刘懿禾, 等. 肝移植术后疑诊急性移植物抗宿主病1例报告:附文献复习 [J]. 实用器官移植电子杂志, 2015, 3(02): 112-5.DOI:10.3969/j.issn.2095-5332.2015.02.011.
[52] 汪国营, 唐晖, 易慧敏, 等. 间充质干细胞治疗肝移植术后难治性急性移植物抗宿主病临床研究 [J]. 中华移植杂志(电子版), 2015, 9(03): 133-6.DOI:10.3877/cma.j.issn.1674-3903.2015.03.007.
[53] 罗颖, 夏罡, 晏洪波. 肝移植术后表现为中毒性表皮坏死松解症样皮损的急性移植物抗宿主病1例 [J]. 临床皮肤科杂志, 2016, 45(08): 594-5.DOI:10.16761/j.cnki.1000-4963.2016.08.016.
[54] 蒋超, 刘雪岩, 孙晓东, 等. 肝移植受者急性移植物抗宿主病治愈后临床免疫耐受一例报道 [J]. 中华器官移植杂志, 2016, 37(12): 731-5.DOI:10.3760/cma.j.issn.0254-1785.2016.12.006.
[55] 骆飞翔. 肝移植术后移植物抗宿主病诊疗策略总结(附7例报告) [D], 2019.
[56] 李君, 范铁艳, 陈虹, 等. 肝移植术后移植物抗宿主病诊治1例 [J]. 实用器官移植电子杂志, 2022, 10(05): 444-7.DOI:10.3969/j.issn.2095-5332.2022.05.014.
[57] ZsÁRy A, SzÛCs S, Keltai K, et al. Endothelins: a Possible Mechanism of Cytostatics-induced Cardiomyopathy [J]. Leukemia & Lymphoma, 2009, 45(2): 351-5.DOI:10.1080/10428190310001593607.
[58] Meves A, el-Azhary RA, Talwalkar JA, et al. Acute graft-versus-host disease after liver transplantation diagnosed by fluorescent in situ hybridization testing of skin biopsy specimens [J]. J Am Acad Dermatol, 2006, 55(4): 642-6.DOI:10.1016/j.jaad.2006.04.073.
[59] Akbulut S, Yilmaz M, Yilmaz S. Graft-versus-host disease after liver transplantation: a comprehensive literature review [J]. World J Gastroenterol, 2012, 18(37): 5240-8.DOI:10.3748/wjg.v18.i37.5240.
[60] Kim GY, Schmelkin LA, Davis MDP, et al. Dermatologic manifestations of solid organ transplantation-associated graft-versus-host disease: A systematic review [J]. J Am Acad Dermatol, 2018, 78(6): 1097-101 e1.DOI:10.1016/j.jaad.2017.12.050.
[61] Gonultas F, Akbulut S, Barut B, et al. Graft-versus-host disease after living donor liver transplantation: an unpredictable troublesome complication for liver transplant centers [J]. European Journal of Gastroenterology & Hepatology, 2020, 32(1): 95-100.DOI:10.1097/meg.0000000000001530.
[62] Murali AR, Chandra S, Stewart Z, et al. Graft Versus Host Disease After Liver Transplantation in Adults: A Case series, Review of Literature, and an Approach to Management [J]. Transplantation, 2016, 100(12): 2661-70.DOI:10.1097/TP.0000000000001406.
[63] Ganoza A, Mazariegos GV, Khanna A. Current status of graft-versus-host disease after intestinal transplantation [J]. Curr Opin Organ Transplant, 2019, 24(2): 199-206.DOI:10.1097/MOT.0000000000000624.
[64] Hudspeth M, Turner A, Miller N, et al. Pancytopenia after allogeneic bone marrow transplant due to copper deficiency [J]. J Pediatr Hematol Oncol, 2014, 36(4): 316-8.DOI:10.1097/MPH.0b013e318290c644.
[65] Hung YT, Chang YR, Wang HN, et al. Diagnostic and therapeutic dilemma in Stevens-Johnson syndrome-like acute graft-versus-host disease after liver transplantation: A case report [J]. Front Immunol, 2022, 13: 917782.DOI:10.3389/fimmu.2022.917782.
[66] Zeiser R, Teshima T. Nonclassical manifestations of acute GVHD [J]. Blood, 2021, 138(22): 2165-72.DOI:10.1182/blood.2021012431.
[67] Pahari H, Nagai S, Skorupski S, et al. Graft-versus-host disease of the central nervous system after liver transplantation: A rare complication [J]. American Journal of Transplantation, 2018, 18(10): 2591-4.DOI:10.1111/ajt.14981.
[68] Massey V, Martel V, Nguyen DK, et al. Acute central nervous system graft-versus-host-disease after liver transplantation [J]. Transpl Immunol, 2022, 70: 101521.DOI:10.1016/j.trim.2021.101521.
[69] 王静文, 王政禄, 印志琪, 等. 肝移植术后移植物抗宿主病的皮肤病理学特征分析 [J]. 实用器官移植电子杂志, 2023, 11(05): 430-5.DOI:10.3969/j.issn.2095-5332.2023.05.008.
[70] Shulman HM, Kleiner D, Lee SJ, et al. Histopathologic diagnosis of chronic graft-versus-host disease: National Institutes of Health Consensus Development Project on Criteria for Clinical Trials in Chronic Graft-versus-Host Disease: II. Pathology Working Group Report [J]. Biol Blood Marrow Transplant, 2006, 12(1): 31-47.DOI:10.1016/j.bbmt.2005.10.023.
[71] Xu CF, Zhu LX, Xu XM, et al. Endoscopic diagnosis of gastrointestinal graft-versus-host disease [J]. World J Gastroenterol, 2008, 14(14): 2262-7.DOI:10.3748/wjg.14.2262.
[72] 杨靖波. 肝移植术后移植物抗宿主病诊治进展 [J]. 实用器官移植电子杂志, 2015, 000(003): 187-91.DOI:10.3969/j.issn.2095-5332.2015.03.019.
[73] Gulbahce HE, Brown CA, Wick M, et al. Graft-vs-host disease after solid organ transplant [J]. Am J Clin Pathol, 2003, 119(4): 568-73.DOI:10.1309/395B-X683-QFN6-CJBC.
[74] Nguyen J, Tetzlaff MT, Zhang PJ, et al. Fluorescent in situ hybridization of a skin biopsy: an adjunctive tool to support a diagnosis of graft-versus-host disease [J]. J Am Acad Dermatol, 2011, 64(6): e113-4.DOI:10.1016/j.jaad.2010.09.716.
[75] Domiati-Saad R, Klintmalm GB, Netto G, et al. Acute graft versus host disease after liver transplantation: patterns of lymphocyte chimerism [J]. Am J Transplant, 2005, 5(12): 2968-73.DOI:10.1111/j.1600-6143.2005.01110.x.
[76] Wu SL, Pan CE. Tolerance and chimerism and allogeneic bone marrow/stem cell transplantation in liver transplantation [J]. World J Gastroenterol, 2013, 19(36): 5981-7.DOI:10.3748/wjg.v19.i36.5981.
[77] Chinnakotla S, Smith DM, Domiati-Saad R, et al. Acute graft-versus-host disease after liver transplantation: role of withdrawal of immunosuppression in therapeutic management [J]. Liver Transpl, 2007, 13(1): 157-61.DOI:10.1002/lt.20982.
[78] Peng B, Liu H, Zhuang Q, et al. Detecting chimerism contributes to diagnosis of graft versus host disease after orthotopic liver transplantation [J]. Hepatobiliary Pancreat Dis Int, 2018, 17(4): 363-6.DOI:10.1016/j.hbpd.2018.07.002.
[79] Schrager JJ, Vnencak-Jones CL, Graber SE, et al. Use of short tandem repeats for DNA fingerprinting to rapidly diagnose graft-versus-host disease in solid organ transplant patients [J]. Transplantation, 2006, 81(1): 21-5.DOI:10.1097/01.tp.0000190431.94252.3f.
[80] Dauber EM, Müller C, Sch?Niger-Hekele M, et al. Artificial blood chimerism and graft-versus-host disease after liver transplantation [J]. 2006, 1288(none): 840-2
[81] Kanehira K, Riegert-Johnson DL, Chen D, et al. FISH diagnosis of acute graft-versus-host disease following living-related liver transplant [J]. J Mol Diagn, 2009, 11(4): 355-8.DOI:10.2353/jmoldx.2009.080172.
[82] Meng X-Q, Chen X-H, Sahebally Z, et al. Cytokines are early diagnostic biomarkers of graft-versus-host disease in liver recipients [J]. Hepatobiliary & Pancreatic Diseases International, 2017, 16(1): 45-51.DOI:10.1016/s1499-3872(16)60157-1.
[83] Lewis D, Glehn-Ponsirenas R, Gulbahce N, et al. High levels of donor-derived cell-free DNA in a case of graft-versus-host-disease following liver transplantation [J]. Am J Transplant, 2022, 22(3): 973-6.DOI:10.1111/ajt.16894.
[84] 中华医学会血液学分会干细胞应用学组. 中国异基因造血干细胞移植治疗血液系统疾病专家共识(Ⅲ)——急性移植物抗宿主病(2020年版) [J]. 中华血液学杂志, 2020, (07): 529-36.DOI:10.3760/cma.j.issn.0253-2727.2020.07.001.
[85] Chan EY, Larson AM, Gernsheimer TB, et al. Recipient and donor factors influence the incidence of graft-vs.-host disease in liver transplant patients [J]. Liver Transpl, 2007, 13(4): 516-22.DOI:10.1002/lt.21082.
[86] Yuksekkaya HA, Arikan C, Tumgor G, et al. Late-onset graft-versus-host disease after pediatric living-related liver transplantation for Langerhans cell histiocytosis [J]. Pediatric Transplantation, 2011, 15(6): E105-E9.DOI:10.1111/j.1399-3046.2008.00899.x.
[87] Lehner F, Becker T, Sybrecht L, et al. Successful outcome of acute Graft-versus-host disease in a liver allograft recipient by withdrawal of immunosuppression [J]. Transplantation, 2002, 73(2): 307-10.DOI:10.1097/00007890-200201270-00030.
[88] Chesdachai S, Udompap P, Yetmar ZA, et al. Infectious complications in acute graft-versus-host disease after liver transplantation [J]. Transpl Infect Dis, 2022, 24(4): e13843.DOI:10.1111/tid.13843.
[89] Elfeki MA, Genco PV, Pungpapong S, et al. Abatacept use in graft-versus-host disease after orthotopic liver transplantation: a case report [J]. Transplant Proc, 2014, 46(7): 2422-5.DOI:10.1016/j.transproceed.2014.06.061.
[90] Sudhindran S, Taylor A, Delriviere L, et al. Treatment of graft-versus-host disease after liver transplantation with basiliximab followed by bowel resection [J]. American Journal of Transplantation, 2003, 3(8): 1024-9.DOI:10.1034/j.1600-6143.2003.00108.x.
[91] Rai V, Dietz NE, Agrawal DK. Immunological basis for treatment of graft versus host disease after liver transplant [J]. Expert Rev Clin Immunol, 2016, 12(5): 583-93.DOI:10.1586/1744666X.2016.1145056.
[92] Kobbe G, Schneider P, Rohr U, et al. Treatment of severe steroid refractory acute graft-versus-host disease with infliximab, a chimeric human/mouse antiTNFalpha antibody [J]. Bone marrow transplantation, 2001, 28(1): 47-9.DOI:10.1038/sj.bmt.1703094.
[93] Jacobsohn DA, Hallick J, Anders V, et al. Infliximab for steroid-refractory acute GVHD: A case series [J]. American Journal of Hematology, 2003, 74(2): 119-24.DOI:10.1002/ajh.10392.
[94] Ali R, Ramdial J, Algaze S, et al. The Role of Anti-Thymocyte Globulin or Alemtuzumab-Based Serotherapy in the Prophylaxis and Management of Graft-Versus-Host Disease [J]. Biomedicines, 2017, 5(4).DOI:10.3390/biomedicines5040067.
[95] Byrne JL, Stainer C, Cull G, et al. The effect of the serotherapy regimen used and the marrow cell dose received on rejection, graft-versus-host disease and outcome following unrelated donor bone marrow transplantation for leukaemia [J]. Bone marrow transplantation, 2000, 25(4): 411-7.DOI:10.1038/sj.bmt.1702165.
[96] Kumar A, Reljic T, Hamadani M, et al. Antithymocyte globulin for graft-versus-host disease prophylaxis: an updated systematic review and meta-analysis [J]. Bone marrow transplantation, 2019, 54(7): 1094-106.DOI:10.1038/s41409-018-0393-0.
[97] van der Zwan M, Baan CC, van Gelder T, et al. Review of the Clinical Pharmacokinetics and Pharmacodynamics of Alemtuzumab and Its Use in Kidney Transplantation [J]. Clin Pharmacokinet, 2018, 57(2): 191-207.DOI:10.1007/s40262-017-0573-x.
[98] Solomon SR, Sizemore CA, Ridgeway M, et al. Safety and efficacy of rituximab-based first line treatment of chronic GVHD [J]. Bone marrow transplantation, 2019, 54(8): 1218-26.DOI:10.1038/s41409-018-0399-7.
[99] Zhao Y, Wu H, Shi J, et al. Ruxolitinib combined with etanercept induce a rapid response to corticosteroid‐refractory severe acute graft vs host disease after allogeneic stem cell transplantation: Results of a multi‐center prospective study [J]. American Journal of Hematology, 2020, 95(9): 1075-84.DOI:10.1002/ajh.25898.
[100] Khoury HJ, Langston AA, Kota VK, et al. Ruxolitinib: a steroid sparing agent in chronic graft-versus-host disease [J]. Bone marrow transplantation, 2018, 53(7): 826-31.DOI:10.1038/s41409-017-0081-5.
[101] Zeiser R, Burchert A, Lengerke C, et al. Ruxolitinib in corticosteroid-refractory graft-versus-host disease after allogeneic stem cell transplantation: a multicenter survey [J]. Leukemia, 2015, 29(10): 2062-8.DOI:10.1038/leu.2015.212.
[102] Jacobs MT, Olson M, Ferreira BP, et al. The use of ruxolitinib for acute graft-versus-host disease developing after solid organ transplantation [J]. American Journal of Transplantation, 2020, 20(2): 589-92.DOI:10.1111/ajt.15579.
[103] Kakadia S, Trotta H, Kurczek L, et al. Early Outcomes of Ruxolitinib in the Treatment of Steroid Refractory Graft-versus-host Disease on Liver Transplant Recipients [J]. Transplantation, 2020, 104(8): e247.DOI:10.1097/TP.0000000000003252.
[104] Assadiasl S, Mojtahedi H, Nicknam MH. JAK Inhibitors in Solid Organ Transplantation [J]. J Clin Pharmacol, 2023, 63(12): 1330-43.DOI:10.1002/jcph.2325.
[105] Endo Y, Oshima G, Hibi T, et al. Achievement of Durable and Complete Remission of Graft-versus-host Disease After Liver Transplantation With Ruxolitinib: A Case Report [J]. Transplantation, 2019, 103(11): e375-e7.DOI:10.1097/tp.0000000000002904.
[106] Kohler S, Pascher A, Junge G, et al. Graft versus host disease after liver transplantation - a single center experience and review of literature [J]. Transplant International, 2008, 21(5): 441-51.DOI:10.1111/j.1432-2277.2007.00625.x.
[107] Kriss M, Feliciano J, Fryer J, et al. Haploidentical hematopoietic stem cell transplantation for graft-versus-host disease after liver transplantation [J]. Blood, 2011, 118(12): 3448-9.DOI:10.1182/blood-2011-05-353714.
[108] Shimata K, Sakamoto R, Anan T, et al. Fatal graft-versus-host disease after living-donor liver transplantation from an HLA-DR-mismatched donor [J]. Pediatric Transplantation, 2017, 21(7).DOI:10.1111/petr.13039.
[109] Kuball J, Theobald M, Ferreira EA, et al. Control of organ transplant-associated graft-versus-host disease by activated host lymphocyte infusions [J]. Transplantation, 2004, 78(12): 1774-9.DOI:10.1097/01.tp.0000144183.77279.ec.
[110] Mark W, Ollinger R, Rumpold H, et al. The liver graft as Trojan horse-multilineage donor-derived hematopoiesis after liver transplantation: case report [J]. Transplant Proc, 2013, 45(9): 3438-41.DOI:10.1016/j.transproceed.2013.07.054.
[111] Mora L, Alegre F, Rifon JJ, et al. Treatment of graft-versus-host disease with mesenchymal cells as a complication of a liver transplantation [J]. Rev Esp Enferm Dig, 2018, 110(11): 734-6.DOI:10.17235/reed.2018.5672/2018.
[112] Doney KC, Mielcarek M, Stewart FM, et al. Hematopoietic Cell Transplantation after Solid Organ Transplantation [J]. Biol Blood Marrow Transplant, 2015, 21(12): 2123-8.DOI:10.1016/j.bbmt.2015.08.004.
[113] Cetin M, Akyol G, Gonen ZB, et al. Additional infusions of mesenchymal stem cells improve response rate in multidrug-resistant GvHD patients [J]. Bone marrow transplantation, 2017, 52(5): 783-5.DOI:10.1038/bmt.2017.1.
[114] 吴顺杰, 铁伊静, 李海珍, 等. 肠道移植物抗宿主病的中医证治策略分析 [J]. 中华中医药杂志, 2021, 36(11): 6825-7
[115] 吴顺杰, 铁伊静, 李海珍, 等. 肝脏移植物抗宿主病的中医证治思路探析 [J]. 中华中医药杂志, 2022, 37(03): 1537-40
[116] Xu X, Ling Q, Wei Q, et al. Korean red ginseng: a new approach for the treatment of graft-versus-host disease after liver transplantation [J]. Transplant Proc, 2011, 43(7): 2651-5.DOI:10.1016/j.transproceed.2011.06.032.